УДК 577.352.22:539.143.43
ВЛИЯНИЕ КВЧ-ИЗЛУЧЕНИЯ НИЗКОЙ ИНТЕНСИВНОСТИ НА СТРУКТУРНО-ДИНАМИЧЕСКОЕ СОСТОЯНИЕ
МОДЕЛЬНЫХ БИОМЕМБРАН
А. Ю. Крыницкая1, П. П. Суханов1, Ю. Е. Седельников2
1Казанский государственный технологический университет
2Казанский государственный технический университет
Получена 19 апреля 2011 г.
Аннотация. Проведено исследование влияния электромагнитного излучения крайне высокой частоты на модельные фосфатидилхолиновые липосомы и их водное окружение. Методами ЯМР 31Р-спектроскопии и ПМР - релаксометрии показано, что облучение приводит к снижению подвижности фосфорсодержащих гидрофильных головок и искажению бислойной упаковки липидных молекул в модельной биомембране. В проявлении наблюдаемых эффектов значительная роль принадлежит водному окружению липидов. При этом под действием облучения происходит перестроение аквасфер вокруг координирующих центров фосфолипидов, что на клеточном уровне способствует гармонизации работы организма.
Ключевые слова. Липосомы, электромагнитное излучение миллиметрового диапазона, спектроскопия, ядерный магнитный резонанс, конформация.
Abstract. Researches of extremely high frequencies electromagnetic radiation influence on model phosphatidylcholine liposomes and their aqueous environment are carried out. It is shown by NMR 31Р-spectroscopy and PMR-relaxation, that irradiation of samples leads to the reduction of phosphorus-containing hydrophilic heads and to distortion of lipid molecules bilayer packaging in model biomembrane. It is found that in the manifestation of appropriate effects significant role belongs to lipids water environment, and under irradiation occurs the rebuilding of aquaspheres around coordinating centres of phospholipids, that at cellular level contributes to the harmonization of organism functioning.
Keywords. Liposomes, electromagnetic radiation in the millimeter range, spectroscopy, nuclear magnetic resonance, conformation.
Введение
Физиотерапия в настоящее время рассматривается как один из мощных и одновременно щадящих факторов воздействия на человеческий организм. Среди физиотерапевтических методов особо выделяется КВЧ-терапия. Ее особое положение обусловлено прежде всего практическим отсутствием побочных отрицательных эффектов. И хотя рассматриваемые в литературе механизмы специфичны для заболеваний различной этиологии, представляется возможным рассмотреть природу механизмов воздействия КВЧ-терапии и с более общих позиций. Следует отметить, что ЭМИ КВЧ имеет универсальный характер действия на живые организмы вне зависимости от уровня организации. Эффекты действия мм волн были продемонстрированы на микроорганизмах, высших растениях, человеческом организме [1, 2].
В последнее время основной мишенью действия мм-волн считается водное окружение биологических органелл, и в первую очередь - биологических мембран. Известно, что именно на мембранах расположены рецепторы, запускающие каскады реакций, связанных с формированием клеточного ответа на внешние раздражители [2, 3]. Хорошим аналогом биологических мембран являются модельные липидные мембраны из природного фосфатидилхолина [4, 5]. В связи с этим целью работы явилось исследование молекулярных механизмов воздействия излучения крайне высоких частот (КВЧ) или излучения миллиметрового диапазона низкой интенсивности на модельные липидные мембраны и их водное окружение.
Методика эксперимента
В качестве объекта исследований применялись модельные липидные мембраны, представляющие собой мультислойные фосфатидилхолиновые липосомы, полученные стандартным путем [6]. Облучение образцов проводили на генераторе сигналов высоких частот Г4 - 142 при максимальной выходной мощности 4 мВт/м2. При этом использовались два режима облучения: 61,8 ГГц и 62,6 ГГц в течение 5 минут в тонком слое на чашках Петри при расстоянии от рупора до образца 8 см.
Для оценки влияния физических полей на структурно-динамическое состояние модельных биомембран использовался метод ЯМР. Эксперименты на ядрах 31Р были выполнены на спектрометре Unity 300 фирмы «Varian» на частоте 121 МГц. Длительность 90° импульса составляла 8 мкс. В качестве эталона использовалась ортофосфорная кислота (Н3РО4). При определении структурно-динамических характеристик модельных мембран и водного окружения методом ЯМР-релаксометрии использовался лабораторный ЯМР-релаксометр с рабочей частотой на протонах 19 МГц и временем нечувствительности приемо-передающего тракта 7 мкс. Измерения времен спин - спиновой релаксации проводились методом КПМГ (Карра - Парселла - Мейбума - Гилла) при температуре 25оС. Релаксационные спады копились не менее 10 раз, а полученные экспериментальные данные с помощью ЭВМ усреднялись по 3 - 4 измерениям.
Экспериментальные результаты и их обсуждение
Для оценки влияния ЭМИ КВЧ на физические свойства модельных биомембран использовали ЯМР 31Р спектроскопию и протонную ЯМР – релаксометрию [7]. Оба метода позволяют исследовать структурно- динамическое состояние любой молекулярной системы без разрушающего воздействия на нее, что особенно важно для оценки поведения биологического материала. При этом ЯМР 31Р-спектроскопия зарекомендовала себя как высокоинформативный метод изучения строения и фазового полиморфизма гидратированных фосфолипидов [8]. На рис. 1 представлен спектр ЯМР 31Р водной дисперсии яичного фосфатидилхолина (фл) при температуре 25°С. Этой температуре соответствует жидкокристаллическое состояние липидов в составе мембраны, поскольку температура перехода яичного фосфатидил-холина в стеклообразное состояние Тс лежит в области -7 ÷ -15 °С.
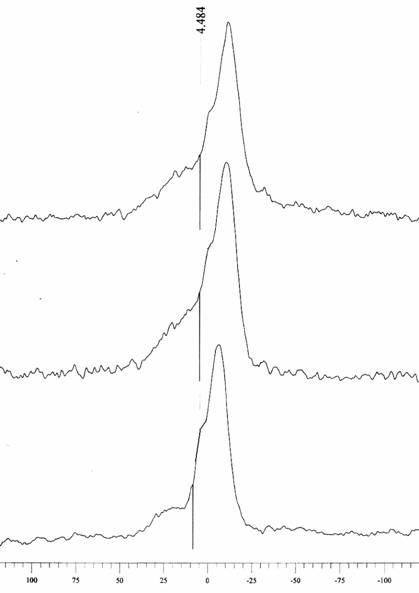
Рис.1. 31Р ЯМР спектроскопия липосом.
Сопоставление формы и параметров этого спектра с литературными данными [7] свидетельствует о том, что данная дисперсия представляет собой бислой, для которого характерен спектр сигналов с интенсивным пиком в области химического сдвига δ ~ -5 м.д. (соответствует более изотропным и подвижным фосфорсодержащим фрагментам) и менее интенсивный пик в области δ ≥ 5 ÷ 20 м.д. (соответствует более заторможенным и упорядоченным (анизотропным) фосфорсодержащим фрагментам). В полученных спектрах водно-липидных систем, облученных КВЧ, наблюдается изменение формы анизотропного (низкоинтенсивного) пика и уширение всех линий на фоне диамагнитного смещения изотропного (высокоинтенсивного) пика симбатно частоте электромагнитного облучения :
контроль (-5 м.д. (1)) → 61,8 ГГц (-10 м.д. (2)) → 62,6 ГГц (-12 м.д. (3)).
Таким образом, данные ЯМР 31Р-спектроскопии облученных образцов указывют на снижение подвижности фосфорсодержащих гидрофильных головок и рост их упорядоченности на фоне общего искажения бислойной упаковки липидных молекул в модельной мембране. Однако остается неясным, оказывает ли КВЧ излучение прямое воздействие на физическое состояние липидов, или же опосредованное - через воду.
Известно, что различные воздействия на воду приводят к перестройкам подсистемы ее водородных связей, которые сопровождаются переходами во внутримолекулярной электронной динамике. Указанные переходы в воде (по типу неравновесных электронных фазовых переходов, хорошо известных для жидких металлов) имеют очень малые энергии и поэтому могут возникать под влиянием низкоэнергетических воздействий. В связи с этим электронная подсистема воды обладает высокой чувствительностью к слабым электромагнитным воздействиям, таким, например, как поля СВЧ - диапазона при плотностях потока мощности порядка единиц мВт/см2, и аналогичные им. Возникающие при этом изменения электронной подсистемы растворителя являются причиной изменения электронной динамики и структуры растворенных молекул. Предполагается, что описанные электронные переходы под влиянием слабых физических воздействий могут наблюдаться непосредственно в липидных мембранах.
Кроме того, динамика протонной системы имеет большое значение для характеристики состояния протоносодержащих молекул, в том числе воды и ее электронных состояний. Поэтому для выяснения механизма воздействия КВЧ излучения миллиметрового диапазона на структурно-динамические характеристики модельных мембран закономерно использовался метод ЯМР – релаксометрии [9]. При этом во всех случаях спады поперечной намагниченности (СПН) представляли собой сумму 2 экспонент с соответствующими временами Т2а (длинное) и Т2в (короткое) с населенностями Р2а и Р2в (долями протонов, релаксирующих с временами Т2а и Т2в соответственно - таблица 1).
Таблица 1
Экспериментальные релаксационные ЯМР-параметры буферных и липосомных контрольных и обработанных на частотах 61,8 и 62,6 ГГц образцов
|
№ |
Образцы |
Т2а, мс |
Т2в, мс |
Р2а, % |
Р2в,% |
|
1 |
Буфер (Б) - контроль |
1050 |
14,7 |
98,5 |
1,5 |
|
2 |
Буфер + 6 1,8 ГГц |
1125 |
20 |
97,7 |
2,3 |
|
3 |
Буфер + 62,6 ГГц |
1115 |
9 |
98 |
2 |
|
4 |
Контроль (Б + фл) |
465 |
15,5 |
93 |
7 |
|
5 |
Б+фл(50 %)+6 1,8 ГГц |
480 |
21 |
91,5 |
8,5 |
|
6 |
Б+фл(50 %)+62,6 ГГЦ |
462 |
12 |
93 |
7 |
Более короткая компонента СПН буферных систем (образцы 1 - 3) по своим параметрам (Т2в, Р2в) соответствует молекулам буфера вместе с 20 - 22 молекулами воды, координированными каждой из молекул буфера. Возможность триса (буфера) образовывать ассоциаты с водой обусловлено, очевидно, наличием у него гидрокси- и аминогрупп, способных взаимодействовать с молекулами воды. Длинная компонента СПН по своим параметрам (Т2а, Р2а) соответствует молекулам воды, не участвующим в заметной координации с буфером. Аналогичная картина наблюдается при насыщении (до 50 % вес.) предыдущих композиций фосфатидилхолином (фл). Однако в этом случае длинная компонента СПН (Т2а) намного короче, чем в буферных системах.
Уменьшение времен Т2а буферных систем с фосфатидилхолином закономерно связано с координацией им основной массы молекул воды. В рассматриваемых образцах (4 - 6) велико содержание фосфатидилхолина. Полярные головки фосфолипидной молекулы состоят из фосфатной и аминной групп, соединенных короткой этиленовой цепочкой -(СН2)2-. Аминная группа заряжена положительно, а фосфатная группа отрицательно, то есть головка фосфолипидных молекул обладает довольно значительным электрическим дипольным моментом, который и обуславливает их гидрофильность. Определенный вклад в суммарный дипольный момент головки вносят также группы С=О [8]. Экспериментально показано, что вода в фосфатидилхолиновых мембранах находится в связанной (гидратные оболочки) и свободной форме. Известно, что одна молекула фосфатидилхолина, образующего ламеллярную структуру (бислойную упаковку) может удержать 22 - 25 молекул воды (из которых 2 -3 связаны сильно, а остальные представляют собой «промежуточный» (между сильно связанной и свободной водой) тип слабо связанной воды). И в нашем случае теоретический анализ и сравнение его результатов с экспериментом подтверждает, что длинная компонента СПН образцов 4–6 соответствует релаксации гидрофобных «концов» липидных молекул и приблизительно того же количества (20-25) слабосвязанных с ними молекул Н2О. Следовательно, рост Р2в образцов 4 - 6 по сравнению с Р2в образцов 1 - 3 обусловлен появлением в системе дополнительных центров, координирующих молекулы воды - «головок» фосфолипида - при добавлении последнего в буфер. Тогда короткая компонента Т2в в системах с фосфатидилхолином также соответствует релаксации 2 - 3 молекул воды, жестко координированных каждой головкой фосфолипида.
При облучении всех опытных образцов (независимо от их состава: буфер или 50 % фосфолипидная дисперсия) наблюдается рост Т2в на частоте 61,8 ГГц и уменьшение Т2в на частоте 62,6 ГГц относительно контроля. Исходя из принятой интерпретации релаксационных параметров можно предположить, что это обусловлено перестроением аквасфер вокруг координирующих центров: ее относительным уплотнением в образцах 3 и 6 и разупорядочиванием в образцах 2 и 5. При этом, судя по данным ЯМР 31Р-спектроскопии (рис. 1), в облученной обоими частотами модельной мембране наблюдается снижение подвижности и(или) рост упорядоченности фосфорсодержащих головок и искажение бислойной упаковки липидных молекул. По-видимому, механизм и направление этих искажений зависит от частоты облучения: если при 61,8 Ггц ассоциированные с головками липосомы фосфолипидов молекулы воды получают дополнительный свободный объем для своего движения (рост Т2в), то при 62,6 ГГц наблюдается обратная картина (падение Т2в), свидетельствующая об уплотнении поверхностного водно-липидного слоя и(или) о росте энергии взаимодействия его компонентов. Таким образом, при облучении на частоте 61,8 Ггц происходит разрыхление (разупорядочивание) водного окружения фосфолипидов, а при 62,6 ГГц – наоборот – структурирование. И в обоих случаях это происходит на фоне возрастающей по сравнению с контролем плотности упаковки фосфолипидных головок.
Подобное сочетание факторов можно объяснить изменениями в донорно-акцепторных свойствах отдельных фосфор- и(или) аминосодержащих комплексов в составе головок и(или) энерготопологических характеристик как поверхности фосфолипида в целом, так и контактирующей с ней воды, или и того, и другого одновременно. Масштабы и возможные последствия этого чрезвычайно обширны – от изменений в конформационном наборе и(или) в размерах головок, степени ассоциации самих липосом, до фазовых переходов типа бислой – мицелла.
Данные ЯМР 31Р - спектроскопии и ЯМР-релаксометрии указывают на искажение бислойной организации модельной мембраны, разрыхление упаковки и рост подвижности липидных молекул в бислойной структуре. Полученные результаты также свидетельствуют о том, что в проявлении наблюдаемых эффектов значительная роль принадлежит водному окружению липидов. Под действием облучения происходит перестроение аквасфер вокруг координирующих центров фосфолипидов, что на клеточном уровне положительно сказывается на жизнедеятельности организма.
Литература
1. Бецкий, О.В. Миллиметровые волны и живые системы / О.В. Бецкий, В.В. Кислов, Н.Н. Лебедева. - М.: САЙНС-ПРЕСС, 2004. - 272с.
2. Ордынская, Т.А. Волновая терапия / Т.А.Ордынская, П.В.Поручиков, В.Ф. Ордынский. – М.: Эксмо, 2008. – 496с.
3.
Егоров, Н.С. Изучение механизмов нетеплового воздействия
миллиметрового излучения на биологически активные соединения/
Н.С. Егоров, М.Б. Голант // Биофизика. - 1997. - №8. - С.14 - 20.
4. Lasic, D.D. Liposomes: From Physics to Applications / Amsterdam: Elsevier, 1993.
5. Барсуков, Л.И. Липосомы / Л.И. Барсуков.// Соровский образовательный журнал. – 1998. - № 10. С. 2 – 9.
6. Gregoriadis, G. Liposome Technology, V. 1 – 3. / G. Gregoriadis // CRC Press, Boca Raton, FL, USA, 1984.
7. Хауссер, К.Х. ЯМР в медицине и биологии: структура молекул, томография, спектроскопия in – vivo / К.Х. Хауссер, Х.Р.Кальбитцер. - Киев: Наукова думка, 1993. - 262с.
8. Бергельсон, Л.Д. Мембраны, молекулы, клетки / Л.Д. Бергельсон. - М.: Наука, 1982.-163с.
9. Pervushin, K. Attenuated T2 relaxation by mutual cancellation of dipole-dipole coupling and chemical shift anisotropy indicates an avenue to NMR structures of very large biological macromolecules in solution / K. Pervushin, R. Riek, G. Wider and K. Wüthrich // Proc. Natl. Acad. Sci. USA , 1997, 94, 1236-1237.