ПОЛУЧЕНИЕ ИЗОБРАЖЕНИЙ В МАГНИТНО-РЕЗОНАНСНОЙ ТОМОГРАФИИ НА ЯДРАХ 19F С ПОМОЩЬЮ ПРЕПАРАТА ПЕРФТОРАН
М. В. Гуляев 1, Л. Л. Гервиц 2, Ю. А. Устынюк 1, Н. В. Анисимов 1, Ю. А. Пирогов 1, А. Р. Хохлов 1
1 Московский государственный университет имени М.В.Ломоносова
2 Институт элементоорганических соединений имени А.Н.Несмеянова
Получена 20 августа 2013 г.
Аннотация. Высокий магнитный момент ядра фтора-19 и его стопроцентное природное содержание являются благоприятными факторами для его использования в МРТ. В качестве веществ, содержащих ядра фтора-19, использовали перфтордекалин и перфторан. Данные вещества биологически инертны, не подвергаются метаболизму в живых организмах и полностью выводятся из него в неизменном виде. С помощью биоспектротомографа отработаны протоколы сканирования и методы получения 19F-МРТ-изображений. Получены 1H- и 19F-МРТ-изображения фантомов и внутренних органов малых лабораторных животных. Совместная регистрация и обработка МРТ-изображений на протонах и ядрах фтора-19 существенно повышает контрастность и информативность изображений, увеличивает диагностическую ценность исследования.
Ключевые слова: медицинская физика, магнитно-резонансная томография, 19F-МРТ-изображения, биоспектротомограф, перфтордекалин, перфторан.
Abstract. The high magnetic moment of the nucleus 19-fluorine and its wholly-owned natural content are favorable factors for its usage in MRI. Perfluorodecalin and perftoran were used as the substances containing the nucleus 19-fluorine. These substances are biologically inert, not metabolized in living organisms and completely removed from it in an unchanged form. The scan protocols and methods of obtaining 19F-MRI images were worked out with biospectral MRI scanner. Also 1H- and 19F-MRI images of phantoms and internal organs of rats were obtained. Joint registration and processing of 1H- and 19F-MRI images significantly improves the contrast and the information content of images, increases the diagnostic value of study.
Keywords: medical physics, magnetic resonance imaging, 19F-MRI images, biospectral MRI scanner, perfluorodecalin, perftoran.
1. Введение
Магнитно-резонансная томография (МРТ) – один из самых мощных неинвазивных методов медицинской диагностики – позволяет получать исчерпывающую информацию о строении внутренних органов и всего тела человека и животных и всего тела в виде как послойных срезов в разных плоскостях, так и объемных образов [1].
Несмотря на то, что с помощью МРТ на протонах достигнуты выдающиеся результаты, все отчетливее проявляются и вполне очевидные недостатки [2]. Главный из них – невысокая интенсивность сигналов ЯМР, которые приходится регистрировать. Низкая чувствительность затрудняет наблюдение работы органов, находящихся в постоянном движении. Не удается получить интенсивные сигналы от тканей, находящихся на слизистых оболочках органов и других поверхностях.
Чтобы скомпенсировать эти недостатки, можно дополнить обычную протонную МР-томографию МРТ-изображениями, полученными на других ядрах. Исключительно перспективным ядром для томографических измерений является фтор-19 [3]. Он имеет почти такой же большой магнитный момент (40 МГц/Тл), как и протон (42,6 МГц/Тл), и его природное содержание составляет 100%. Ядер 19F в живых организмах практически нет, однако возможности реализовать томографию на ядрах фтор-19 (19F-МРТ) появляются благодаря особым свойствам фторорганических соединений, в которых с углеродом вместо атомов водорода связаны атомы фтора. Такие соединения называют перфторуглеродами (ПФУ) или перфторуглеводородами. Как природные соединения они отсутствуют и являются синтезированными химически.
Большой вклад в развитие этой области внесли сотрудники Института элементоорганических соединений имени А.Н.Несмеянова РАН (ИНЭОС). Уже на ранних стадиях изучения ПФУ было установлено, что они способны растворять очень большие объемы газов [4-5]. Например, жидкие ПФУ в виде субмикронных водных эмульсий (диаметр капель 70–100 нм) способны растворять более 50% по объему кислорода и более 150% углекислого газа. Было обнаружено, что мышь, полностью погруженная в жидкость ПФУ, может несколько часов «дышать» растворенным в этой жидкости кислородом. ПФУ совершенно инертны, они не токсичны, а будучи введенными в организм не подвергаются метаболизму и выводятся в основном с выдыхаемым воздухом. Сразу же после этого открытия в СССР и других странах начались работы по созданию заменителя плазмы крови на основе ПФУ. Здесь наибольших успехов добились российский ученые. Объединенный научный коллектив Института биофизики и ИНЭОС РАН разработал рецептуру препарата «перфторан», а также технологию его производства [6-8].
Перфторан представляет собой водную микроэмульсию смеси двух перфторорганических соединений, стабилизированную полимерным ПАВ, размер капель 70-100 нм. Он с высокой скоростью растворяет большие объемы кислорода, обеспечивает доставку кислорода из альвеол к эритроцитам и от эритроцитов к тканям, улучшает метаболизм и газообмен на уровне тканей, а также обладает отчетливым кардиопротекторным эффектом. Минздрав разрешил его использование в качестве кровезаменителя. Такое разрешение на клиническое использование перфторана имеется только в России, что позволяет у нас, в отличие от других стран, беспрепятственно проводить широкие эксперименты с применением этого препарата и первыми получать принципиально новые биомедицинские результаты.
Свойства перфторана позволяют без вреда для организма создавать его значительные концентрации в живых тканях, что открывает уникальную возможность использовать его для разработки нового мощного метода медицинской диагностики на основе ЯМР-томографии при детектировании сигналов фтора-19 (19F-МРТ) [9-10]. В самом деле, при почти полном отсутствии в теле человека и животных атомов фтора ЯМР томография легко обнаруживает любой фторсодержащий препарат, введенный в организм для исследовательских или терапевтических целей. Методом 19F-МРТ можно наблюдать за наполнением кровеносной системы перфтораном, регистрировать морфологию стенок слабо видимых при рутинной томографии органов, например, легких или кишечника, заполненных перфтораном, следить за перемещением молекул препаратов, снабженных метками фтора, и т.п. Такие возможности были замечены в ряде научно-исследовательских лабораторий разных стран – Голландии, США, Японии. На искусственных объектах (фантомах) и на лабораторных животных были получены интенсивные сигналы 19F-ЯМР и трехмерные изображения весьма высокой контрастности. Однако, в связи с тем, что ни в одной из этих стран нет препарата типа перфторан, прошедшего полный цикл клинических исследований и разрешенного к медицинским применениям, эти результаты носят разрозненный характер и не являются вполне достоверными.
Опираясь на известные данные и на большой опыт работы с перфтораном в ИНЭОС РАН и Институте экспериментальной и теоретической биофизики (основных разработчиков препарата), мы в содружестве с этими коллективами провели серию экспериментов, направленных на разработку метода магнитно-резонансной томографии на ядрах фтора-19 (19F-МРТ).
2. Постановка эксперимента
Для реализации данного метода использовался высокопольный биоспектротомограф фирмы Bruker BioSpec 70/30 USR с постоянным магнитным полем 7 Тл, имеющийся в Центре магнитной томографии и спектроскопии МГУ и предназначенный для биомедицинских исследований малых лабораторных животных – мышей, крыс или кошек (рис.1).

Рис. 1. Внешний вид 7-Тл биоспектротомографа Bruker BioSpec 70/30 URS.
Резонансная частота протонов, на которой работает приемо-передающий тракт этого томографа в поле 7 Тл составляет 300,2 МГЦ. Для получения 19F-МРТ-изображений приемо-передающая катушка в поле 7 Тл должна быть настроена на частоту резонанса ядер 19F около 282,5 МГц.
Благодаря относительно небольшой разнице в величине резонансных частот ядер водорода и фтора-19 удалось осуществлять МРТ сканирование с использованием одной приемо-передающей катушки (рис.2). Это позволило проводить МРТ эксперименты на разных ядрах при одном и том же положении исследуемого объекта, как бы дополняя одно исследование другим. Это является весьма важным и для клинических применений, поскольку значительно сокращает время исследования.

Рис. 2. Катушка для получения 1H- и 19F-МРТ-изображений.
Исходя из основного уравнения ЯМР B0 = γω0, где B0 – постоянное магнитное поле, γ – гиромагнитное отношение, ω0 – резонансная частота, можно заметить, что чем меньше поле B0, тем меньше разница в резонансных частотах ядер протона и фтора-19. Кстати, это облегчает задачу сбора данных на разных ядрах в более слабых (характерных для медицинских МРТ сканеров) магнитных полях при неизменном положении исследуемого объекта, что действительно может пригодиться в клинике.
3. Результаты экспериментов
Рассмотрим химический состав перфторана. Он состоит из следующих компонентов, растворенных в 100 мл воды: перфтордекалин – 13 г, перфторметилциклогексилпиперидин – 6,5 г, проксанол-268 – 4 г, хлорид натрия – 0,6 г, глюкоза – 0,2 г, гидрокарбонат натрия – 0,065 г, хлорид калия – 0,039 г, натрия гидрофосфат: 0,02 г., магния хлорид: 0,019 г., вода: до 100 мл. Химические формулы основных компонентов перфторана представлены на рис.3.
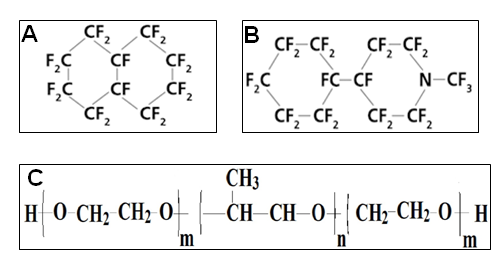
Рис. 3. Основные составные элементы перфторана: перфтордекалин (A); перфторметилциклогексилпиперидин (B); проксанол-268 (C).
Исходя из химического состава перфторана видно, что спектр данного препарата довольно богатый и содержит множество спектральных линий с частотами около 282,5 МГц (рис. 4).
Как отмечалось выше, ядра фтора-19 имеют высокие значения гиромагнитного отношения и относительной чувствительности, благодаря чему ЯМР сигнал получается довольно сильным. Кроме того, как видно из рис. 4 спектр водного раствора перфторана находится в довольно узкой полосе частот около 35 кГц. Томограф же в процессе настройки выбирает среднее значение резонансной частоты исследуемого препарата, в результате чего отклики будут соответствовать тем веществам, содержащимся в перфторане, которые имеют резонансную частоту, близкую к ларморовой. При этом будет наблюдаться не одно изображение исследуемого объекта, а несколько, наложенных друг на друга.

Рис. 4. ЯМР спектр 70% водного раствора перфторана.
Наглядный пример такого явления представлен на рис. 5B: это 19F-МРТ-изображение наполненной водным раствором перфторана трубки, расположенной в фантоме, заполненном водой. Резонансная частота, на которую был настроен биоспектротомограф, ориентируясь на ядра фтора-19, составляла 282,4918 МГц. Возле этой частоты в спектре 19F имеется несколько ярких спектральных линий, почему и наблюдается наложение изображений друг на друга. На рис. 5C представлено изображение той же трубки, только частота для ядер фтора-19 была выбрана равной 282,4746 МГц – частоте уединенной спектральной линии. Наложение изображений уже не наблюдается. Поэтому, зная резонансную частоту определенных веществ в составе перфторана, можно получать 19F-МРТ-изображения именно от ядер данных веществ без наложения изображений друг на друга. Для сравнения на рис. 5A представлено МРТ-изображение, полученное на протонах.
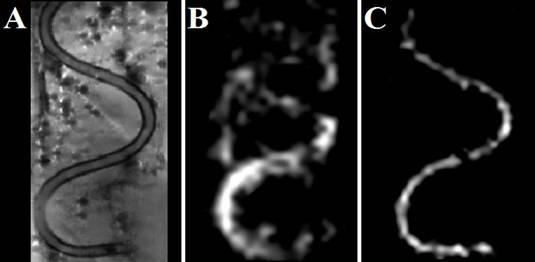
Рис. 5. Изображения трубки, наполненной 70% водным раствором перфторана. А: МРТ-изображение, полученное на протонах; B, C: 19F-МРТ-изображения (резонансная частота 282,4918 МГЦ и 282,4746 МГЦ соответственно).
Избавиться от наложения изображений можно также следующим образом. Немаловажную роль играют сама импульсная последовательность и длительности импульсов, ее составляющих. Так, в экспериментах на фантомах выяснилось, что более качественное изображение получается при использовании последовательности MSME – мульти-спин-мульти-эхо в трактовке [11-12]. В этой последовательности используются 2 импульса. Один – 900-ый возбуждающий, второй – 1800-ый инвертирующий. При определенных длительностях импульсов удается погасить эффект наложения, как показано на рис. 6, где дается 19F-МРТ-изображение поперечного сечения пробирки, наполненной 70% водным раствором перфторана, полученное в режиме MSME. В эксперименте использовались эрмитовы радиоимпульсы длительностью τ и частотной шириной W.
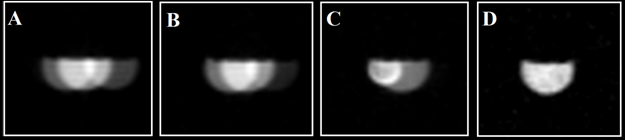
Рис. 6. 19F-МРТ-изображения пробирки, наполненной 70% водным раствором
перфторана, полученное в режиме MSME при
различных длительностях импульсов. А: 900-ый импульс (τ =
13,5 мс, W = 400 Hz), 1800-ый (τ = 8,5
мс, W = 400 Hz); B: 900-ый
(τ = 18 мс, W = 300 Hz), 1800-ый
(τ = 11,4 мс, W = 300 Hz); C: 900-ый (τ = 27 мс,
W = 200 Hz), 1800-ый (τ = 17,1
мс, W = 200 Hz); D: 900-ый
(τ = 54 мс, W = 100 Hz), 1800-ый
(τ = 34,2 мс, W = 100 Hz).
Помимо отработки получения 19F-МРТ-изображений на фантомах был проделан ряд экспериментов на малых животных – крысах Wistar. В левую лапу крысе было подкожно введено 2 мл перфтордекалина (рис. 7).

Рис. 7. МРТ-изображения верхних
конечностей крысы. Стрелкой отмечен перфтордекалин. A: 1H-МРТ-изображение;
B: 19F-МРТ-изображение;
C: Наложение 1H- и 19F-МРТ-изображений.
На протонном (1H-МРТ) изображении заполненный перфтордекалином объем выглядит черным пятном (рис. 7A). Сигнал от протонов в этом месте отсутствует. Однако на 19F-МРТ-изображении (рис. 7B) можно видеть уже яркое пятно в области инъекции фторсодержащего препарата. Совмещение 1H- и 19F-МРТ-изображений (рис. 7C) дает более четкую картину визуализации перфтордекалина на фоне 1H-МРТ-изображении.
Кроме того, было проведено МРТ сканирование брюшной полости крысы, которой перорально ввели 20 мл перфтордекалина и наблюдали по 1Н- и 19F-МРТ-изображениям за его распространением по кишечнику. На 1H-МРТ-изображении кишечник практически не дает сигнала, так как содержит преимущественно полости.
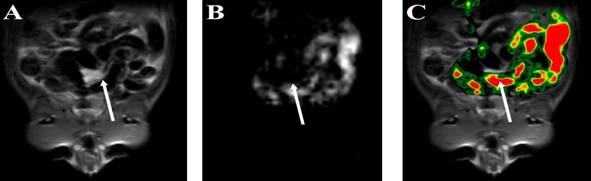
Рис. 8. МРТ-изображения кишечника крысы на протонах (A), ядрах 19F (B) и совмещенное изображение после перорального введения 20 мл перфтордекалина (C). Стрелкой отмечена брюшная полость крысы.
Регистрацию сигнала от ядер фтора-19 проводили при толщине среза 5 мм. На рис. 8 представлены 1H- (A) и 19F-МРТ-изображения (B) и совмещенное изображение для одного из временных интервалов (C). 19F-МРТ-изображения дают возможность проследить, как в динамике происходит транспортировка перфтордекалина по кишечнику, какие препятствия при этом возникают.
4. Выводы
Применение стабильных субмикронных (диаметр капель 70–100 нм) водных эмульсий нетоксичных перфторуглеродов открывает возможность создать новый метод магнитно-резонансной томографии с регистрацией сигнала по ядрам фтора-19 (19F-МРТ), существенно расширяющий границы биомедицинских и технических приложений МРТ.
Эмульсии ПФУ могут быть использованы как транспортные платформы (контейнеры) для целевой доставки в органы и ткани лекарственных препаратов и контрастирующих агентов в режиме 19F-МРТ визуализации процессов фармакокинетики.
Совместная регистрация и обработка МРТ-изображений на протонах и ядрах фтора-19 существенно повышает контрастность и информативность изображений.
Литература
1. Ринкк П.А. Магнитный резонанс в медицине // М., Геотар-Мед, 2003.
2. William Oldendorf M.D., William Oldendorf Jr. Advantages and Disadvantages of MRI // Basics of Magnetic Resonance Imaging, Topics in Neurology, Volume 1, 1987, 125-138.
3. Jesus Ruiz-Cabello, Brad P. Barnett, and Jeff W.M. Bulte Fluorine (19F) MRS and MRI in biomedicine // NMR Biomed., 2011, 24(2), 114-129.
4. Маевский Е.И. Биологические эффекты фторуглеродов и проксанолов // Перфторированные углероды в биологии и медицине: Сб. - Пущино, 1980, 76-81.
5. Белоярцев Ф.Ф., Кнунянц И.Л., Иваницкий Г.Р. Создание и исследование сред для трансфузии – переносчиков кислорода на основе фтороуглеродов // Анестезиология и реаниматология, 1985, №3, 73-77.
6. Мороз В.В., Крылов Н.Л., Иваницкий Г.Р. Применение Перфторана в клинической медицине // Анестиология и реаниматология, 1995, №6, 12-17.
7. Maevsky, E., Ivanitsky H., Bogdanova L., Axenova O., Karmen N., Zhiburt E. Clinical results of Perftoran application: present and future // Artificial Cells, Blood Substitutes, and Biotechnology, 2005, 33, 37-46.
8. Maevsky, E.I., Ivanitsky, H.R., Islamov B.I., Moroz V.V., Bogdanova L.A. Karmen N.B., Pushkin S.Yu., Maslenikov I.A. Perftoran // Chapter 26 in R.M. Winslow (ed.) ―Blood Substitutes, Elsevier, Acad. Press, 2004, 288-297.
9. Nelson T.R. et al. Fluorine nuclear magnetic resonance: calibration and system optimization // Magn. Reson. Imaging, 1985, 3, 267–273.
10. Schnur G., Kimmich R., Lietzenmayer R. Hydrogen/fluorine retuning tomography. Applications to 1H image-guided volume-selective 19F spectroscopy and relaxometry of perfluorocarbon emulsions in tissue // Magn. Reson. Med., 1990, 13, №3,478-489.
11. Анисимов Н.В., Губский Л.В., Гладун В.В., Ю.А.Пирогов. Управление контрастом и информационные технологии в магнитно-резонансной томографии / Под ред. проф. Ю.А.Пирогова.- М.: Изд-во физич. ф-та МГУ, 2005, 144 с.
12. Анисимов Н.В., Батова С.С., Пирогов Ю.А. Магнитно-резонансная томография: управление контрастом и междисциплинарные приложения / Под ред. проф. Ю.А.Пирогова.- М.: МАКС Пресс, 2013, 244 с.