УДК 535.34, 535-14, 539.199, 542.08, 51-7
Применение методов терагерцевой спектроскопии для изучения водных растворов биомолекул
Ю. С. Гусева1,2, А. В. Семенова1,2, А. Н. Панин2, В. Л. Вакс1,2
1Нижегородский государственный университет им. Н.И. Лобачевского
2 Институт физики микроструктур РАН
Статья поступила в редакцию 25 января 2016 г.
Аннотация. Данная работа направлена на развитие методов прецизионной терагерцевой спектроскопии водных растворов биологических молекул для приложений неинвазивной биомедицинской диагностики. Экспериментально исследовались спектры образца ДНК сельди и препарата инсулина человека. Теоретически моделировался спектр поглощения ДНК в терагерцевом диапазоне. Сравнивались спектры, полученные методом терагерцевой спектроскопии высокого разрешения на основе микроволнового подхода, и стандартными квазиоптическими методами. Было показано, что разрешающей способности стандартных методов ТГц спектроскопии недостаточно для исследования тонкой структуры спектрoв биологических молекул.
Ключевые слова: терагерцевый диапазон, спектроскопия высокого разрешения, биомолекулы, спектры жидкостей, низкочастотные колебания, моделирование динамики ДНК.
Abstract. This work is devoted to developing the precise terahertz spectroscopy of aqueous solutions containing biological molecules for applications of non-invasive biomedical diagnostics. Spectra of the herring`s DNA and insulin-based drug were under study experimentally. An absorption spectrum of DNA was simulated in the terahertz range. We compared the spectra obtained with terahertz high-resolution spectroscopy based on microwave approach with such given by standard quasi-optical methods. Standard methods of THz spectroscopy are shown to have insufficient spectral resolution for studying the fine structure of biological molecules spectra.
Key words: terahertz frequency range, high-resolution spectroscopy, biomolecules, spectra of liquids, low- frequency oscillations, modeling of DNA`s dynamics.
Введение
Абсорбционная спектроскопия терагерцевого (ТГц) диапазона частот является одним из перспективных способов изучения крупных биологических молекул, таких как ДНК, РНК, белки и др. [1, 2]. ТГц диапазон содержит частоты групповых колебаний макромолекул, отвечающих масштабным структурным движениям, в частности, колебаниям водородных связей, поддерживающих третичную структуру молекул, а изменение пространственной геометрии молекул может повлечь изменение характера ТГц спектров поглощения. В отличие от методов микроскопии или рентгеноструктурного анализа, требующих особых манипуляций с образцами биомолекул (в частности, осаждение молекул на специальной подложке, выращивание кристаллов, применение специальных реагентов), которые, если не повреждают, то меняют исходную структуру молекул, спектроскопические исследования могут проводиться неинвазивно.
Целью работы являются экспериментальные исследования спектров поглощения биоматериалов в ТГц (субТГц) диапазоне с высоким спектральным разрешением и развитие неинвазивной биомедицинской диагностики на их основе. Одна из задач – изучение динамики биомолекул (ДНК, РНК, белки) в естественном для них окружении, т.е. в водной среде.
Существенную проблему для изучения биомолекул в условиях, близких к естественным, представляет интенсивное поглощение излучения ТГц частотного диапазона жидкой водой. Поэтому в некоторых работах образцы подвергали специальной подготовке, например, высушивали, спрессовывали в пластинки или гранулы [3, 4] и т.д., что в свою очередь не могло не повлиять на конформационную динамику и функции биомолекул. В то же время на частотах ниже 1 ТГц (субТГц), вода поглощает слабее, чем в дальнем ИК диапазоне или СВЧ, с этой точки зрения субТГц диапазон может быть наиболее привлекателен.
Кроме этого для измерений в открытом пространстве требуется достаточно высокая производительность устройств и, как правило, относительно большое количество исследуемого вещества, что, в свою очередь, существенно повышает расходы на проведение эксперимента. Можно прибегнуть к повышению мощности излучения, действующего на образец, но в этом случае воздействие может оказаться повреждающим. Решение указанных выше проблем может быть найдено в увеличении чувствительности метода, например, за счет применения высокодобротного резонатора (ВР). Применение ВР является одним из способов улучшения чувствительности, реализованном в ИК, видимом и УФ диапазонах [5, 6]. В ряде работ сообщается о перспективности использования ВР и в ТГц диапазоне [7, 8].
В настоящее время весомый вклад в изучение растворов биомолекул в ТГц диапазоне внесли две исследовательские группы, представителями которых являются Martina Havenith и Tatiana Globus, использующие в своих работах спектрометры на основе широкополосных источников излучения: мощный p-Ge лазер в области частот ~ 2-3 ТГц [1, 9-11] и Фурье-спектрометр IFS 66 в области ~ 300-750 ГГц [12, 13], соответственно. Следует уточнить, что в первом случае, насколько известно, основным предметом изучения были не спектры поглощения конкретных белковых молекул и аминокислот, а зависимости разностного коэффициента поглощения от концентрации растворов.
Однако серьезным ограничением применимости методов ТГц спектроскопии, основанных на оптических принципах генерации и детектирования излучения, для ряда практических приложений может оказаться спектральное разрешение. Так, например, разрешение ТГц спектрометров на основе фемтосекундных лазеров, как правило, не лучше единиц ГГц [14, 15].
Помимо проблемы получения на практике прецизионных данных о спектре биомолекул важна и правильная интерпретация спектра, что является не менее сложной задачей; ведь спектр низкочастотных колебаний сложных биологических молекул, как, например, ДНК, ожидается насыщенный (с плотностью мод более 1/см-1) [12, 13]. Поэтому необходима адекватная модель, которая бы позволила выявить общие закономерности динамики биомолекул [16].
В статье совместно представлены некоторые результаты по математическому моделированию свойств ДНК в ТГц диапазоне, а также данные, полученные с применением измерительной установки на основе стабилизированной по частоте лампы обратной волны для ДНК в виде сухого порошка и препарата инсулина в форме раствора на частотах около 300 ГГц в сравнении с другими широко используемыми методами (техника Time Domain Terahertz Spectroscopy с преобразованием излучения фемтосекундного лазера в терагерцевые импульсы и коммерческий Фурье-спектрометр в режимах сканирования с различной разрешающей способностью).
2. Модель для описания низкочастотных колебаний ДНК
ДНК является полярной молекулой и представляет собой спирально-закрученную двойную цепь, стабилизированную водородными связями между парами нуклеотидов. Динамика ДНК рассматривалась в рамках приближения самосогласованных фононных мод, применяющегося для описания термодинамики колебаний ДНК [17] и распространения по ДНК солитонов [18]. Каждая пара нуклеотидов принималась за осциллятор, упруго связанный с соседними нуклеотидами. Поскольку энергия ТГц излучения в спектроскопических экспериментах, как правило, мала, то все осцилляторы и связи можно рассматривать как линейные. Предполагалось, что нуклеотиды в каждой паре несут разноименные заряды и могут смещаться только вдоль соединяющей их водородной связи.
На рис.1 представлено схематическое изображение молекулы ДНК (спиральная структура опущена). Ось xn направлена в каждой паре нуклеотидов вдоль водородной связи; ось z направлена параллельно оси двойной спирали.
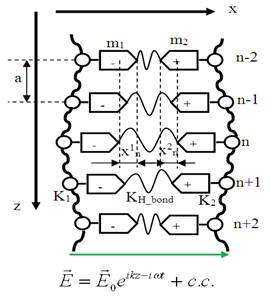
Рис. 1. Изображение ДНК в рамках модели.
В этом случае колебания ДНК описываются Гамильтонианом:
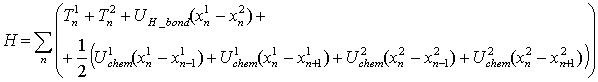 , (1)
, (1)
где T1n - кинетическая энергия соответствующего нуклеотида (верхний индекс означает цепочку, нижний – номер нуклеотида), UH_bond – энергия деформации водородных связей, а U1,2chem – энергия деформации химических связей в цепочке ДНК.
Дисперсионная характеристика колебаний цепочки содержит две ветви: «акустическую» (нуклеотиды движутся в фазе) и «оптическую» (нуклеотиды движутся в противофазе).
Для расчета поглощения ТГц излучения молекулами ДНК в уравнения движения необходимо добавить диссипацию и взаимодействие с полем внешней электромагнитной волны:
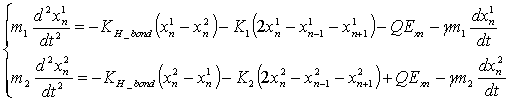 , (2)
, (2)
где Q – заряд нуклеотида, а Exn – проекция электрического поля на ось, параллельную водородной связи в n-ой паре нуклеотидов, γ учитывает диссипацию, а коэффициенты KH_bond и K1,2 соответствуют жесткостям водородных и химических связей.
Из-за спиральной структуры ДНК Exn зависит от номера нуклеотида n:
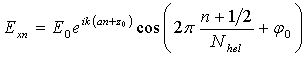 , (3)
, (3)
где Nhel – период двойной спирали ДНК, выраженный в количестве нуклеотидов.
Сильнее всего поглощение происходит на частотах собственных мод, удовлетворяющих условию синхронизма:
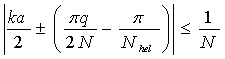 , (4)
, (4)
где a – расстояние между соседними нуклеотидами, q – номер собственной моды, N – длина цепочки.
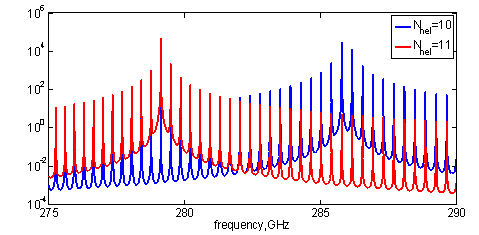
Рис. 2. Участок спектра поглощения,
рассчитанного для ДНК
с периодом спиралей 10 пар оснований (синяя линия) и 11 (красная
линия).
Графики соответствуют оптической ветви.
Моделирование показало, что центральная частота в спектре поглощения ДНК зависит от периода двойной спирали, а расстояние между собственными модами от длины цепочки. Это соответствует общему представлению о том, что ТГц спектры поглощения крупных органических молекул чувствительны к их конформационному и конфигурационному состоянию. Однако, обнаружить подобные эффекты на практике может быть очень проблематично при недостатке спектрального разрешения и чувствительности метода.
3. Экспериментальная техника и первые результаты
В ИФМ РАН разрабатываются ТГц спектрометры на основе микроволнового подхода, сочетающие высокую чувствительность и разрешающую способность одновременно. Для измерения спектра поглощения ДНК была реализована экспериментальная установка с применением ВР (с добротностью до 1,5*105), который особенно эффективен для повышения чувствительности метода, если необходимо изучить слабо-поглощающее вещество в малых количествах. Непрерывное высокостабильное ТГц излучение обеспечивается синтезатором на основе лампы обратной волны (ЛОВ). Ширина полосы генерации составляет ~ 10 Гц. С более подробным описанием методики измерений и принципиальной схемы установки можно ознакомиться в работах [19-21].
Участки спектра деградированной ДНК сельди в виде сухого порошка были изучены в диапазоне 300-320 ГГц с шагом по частоте 50 МГц. С помощью данной техники также исследовались спектральные характеристики раствора на основе инсулина, но уже без использования ВР по техническим причинам.
На рис. 3 и 4 сравниваются спектры, полученные при помощи техники Time Domain Terahertz Spectroscopy (TDTS) из работы [15] и разработанной в ИФМ РАН установки, соответственно.
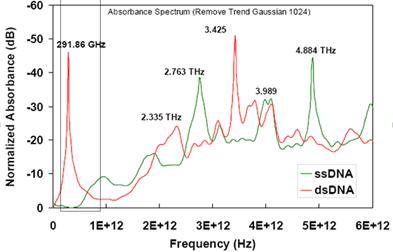
Рис. 3. Спектры поглощения двухцепочечной (красный цветом) и одноцепочечной ДНК сельди [15].
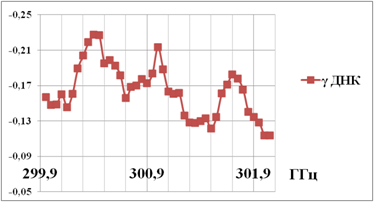
Рис. 4. Небольшой участок спектра
поглощения двухцепочечной ДНК сельди вблизи 300 ГГц [20].
Интенсивность
поглощения выражена в отн.ед.
При помощи TDTS нельзя разрешить несколько близко расположенных полос поглощения, в результате регистрируется огибающая кривая, как на рис. 3. Вблизи 300 ГГц наблюдается один интенсивный пик поглощения.
Применяемая в нашей работе ДНК, возможно, могла состоять из различных по длине фрагментов. Для дальнейших экспериментов потребуется несколько чистых образцов ДНК с известными параметрами.
Далее приведены спектры медицинского препарата на основе инсулина человеческого («Актрапид»), полученные в ИФМ РАН с использованием коммерческого Фурье-спектрометра Bruker и измерительной установки на основе микроволнового подхода, соответственно. В схеме Фурье-спектрометра источником излучения являлась ртутная лампа, приемником - болометр, делителем луча - 50 мкм лавсан. Вследствие аппаратурных ограничений данные ниже 285 ГГц можно не принимать к рассмотрению. К достоинствам данной техники можно отнести возможность более быстрого получения качественных данных в обширном диапазоне частот, т.к. запись спектра происходит в автоматическом режиме.
Данные на рис. 5 получены из отношения амплитуд сигнала, прошедшего через исследуемый образец (канал «sample») и амплитуды опорного сигнала (канал «reference»). Канал «reference» содержал кювету с дистиллированной водой, поскольку исследуемый образец состоял из воды на ~99%.
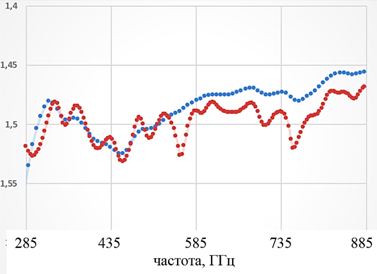
Рис. 5. Инвертированный спектр
пропускания препарата инсулина, полученный
при помощи Фурье-спектрометра с
разрешением 0,5 см-1 (красный) и 1 см-1.
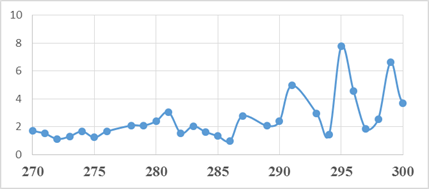
Рис. 6. Инвертированный спектр
пропускания препарата инсулина
в диапазоне 270-300 ГГц. Интенсивность
поглощения выражена в отн.ед.
Из рисунков 5 и 6 видно, что по данным, основывающихся на двух разных методах, вблизи 300 ГГц присутствуют пики, которые могут соответствовать полосам поглощения молекулярных комплексов, содержащих инсулин. Более точная интерпретация представленных спектров, к сожалению, в настоящий момент затруднена в связи с отсутствием необходимых теоретических и экспериментальных данных. Нужны дополнительные исследования и разработка теоретических моделей.
4. Заключение
С применением техники
спектроскопии высокого разрешения на основе микроволнового подхода в рамках
работы были проведены эксперименты по измерению спектров ДНК и препарата
инсулина на водной основе; обнаружены полосы поглощения, которые могут быть
обусловлены собственными колебаниями биомолекул. Результаты были сопоставлены с
данными, полученными при помощи других широко используемых методов ТГц
спектроскопии. Представленные в статье результаты демонстрируют возможности продвигаемого
авторами метода для исследования свойств растворов биомолекул в субТГц
диапазоне. Метод позволяет различить структуру спектра, недоступную для
традиционных спектрометров на основе оптического подхода. В то же время в
работе было проведено моделирование свойств ДНК в субТГц диапазоне.
Предполагается, что с использованием представленной модели, можно будет также
решать и обратные задачи, например, определять геометрические параметры ДНК
(длину и период двойной спирали) по измеренному спектру поглощения. Дальнейшее усовершенствование
метода ТГц спектроскопии с высоким разрешением и будущие результаты могут
способствовать в решении ряда биомедицинских задач, в частности, диагностики
состояния живых организмов по малейшим изменениям пространственной структуры биомолекул
(прогнозирование заболеваний по «неправильной» конформации).
Работа выполнялась при поддержке грантов Минобрнауки РФ № 2014/134 и № 14.607.21.0100, гранта правительства РФ № 11.G34.31.0066.
Литература
1. Vondracek H., Dielmann-Gessner J., et al. THz absorption spectroscopy of solvated β-lactoglobulin // J. Chem. Phys., vol. 141, pp. 22D534(1-6), 2014.
2. Zhang W., Brown E.R., et al. Observation of terahertz absorption signatures in microliter DNA solutions // Appl. Phys. Lett., vol. 102, pp. 023701(1-4), 2013.
3. Yang L., Zhao G., et al. Low-frequency vibrational modes of dl-homocysteic acid and related compounds // Spectrochimica Acta Part A, 73, pp. 884–891, 2009.
4. Fischer B.M., Walther M., et al. Far-infrared vibrational modes of DNA components studied by terahertz time-domain spectroscopy // Phys. Med. Biol., vol. 47, pp. 3807–3814, 2002.
5. Kassi S., Campargue A. Cavity ring down spectroscopy with 5 × 10− 13 cm− 1 sensitivity // J. Chem. Phys., vol. 137, pp. 234201(1-6), 2012.
6. Shucheng X., Guohe S., et al. Cavity ring-down spectroscopy in the liquid phase // Rev. Sci. Instr., vol. 73, pp. 255-258, 2002.
7. Piksa P., Zvánovec S., et al. Specific Millimeter-Wave Features of Fabry-Perot Resonator for Spectroscopic Measurements // In: Microwave and Millimeter Wave Technologies: from Photonic Bandgap Devices to Antenna and Applications. – InTech, 2010. P.451-468
8. Braakman R., Blake G.A. Principles and promise of Fabry–Perot resonators at terahertz frequencies // J. Appl. Phys., vol. 109, pp. 063102(1-11), 2011.
9. Born B., Havenith M., et al. The terahertz dance of water with the proteins: the effect of protein flexibility on the dynamical hydration shell of ubiquitin // Faraday Discuss, vol. 141, pp. 161–173, 2009.
10. Havenith M. THz spectroscopy as a new tool to probe hydration dynamics // Proc. of SPIE, vol. 7600, рр. 76000J(1-5), 2010.
11. Niehues G., Havenith M., et al. Exploring hydrophobicity by THz absorption spectroscopy of solvated amino acids // Faraday Discuss, vol. 150, pp. 193–207, 2011.
12. Parthasarathy R., Globus T., et al. Dielectric properties of biological molecules in the Terahertz gap // Appl. Phys. Lett., vol. 87, pp. 113901(1–3), 2005.
13. Globus T., Khromova T., et al. Terahertz characterization of dilute solutions of DNA // Proc. of SPIE, vol. 6093, pp. 609308(1–12), 2006.
14. Markelz A., Whitmire S., et al. THz time domain spectroscopy of biomolecular conformational modes // Phys. Med. Biol, vol. 47. pp. 3797–3805, 2002.
15. Rahman A., Stanley B., et al. Ultrasensitive label-free detection and quantitation of DNA hybridization via terahertz spectrometry // Proc. of SPIE, vol. 7568, pp. 756810(1-7), 2010.
16. Вакс В.Л., Семенова А.В. Моделирование спектра поглощения ДНК в ТГц диапазоне частот // Сб. тр. ТКМФ - VI. – Троицк-М., Изд-во Троицкий Научный Центр РАН, 2014.- С.348-350.
17. Dauxois T., Peyrard M., Bishop. A.R. Entropy-driven DNA denaturation // Phys. Rev. E, vol. 47, no 1, pp. R44 – R47, Jan. 1993.
18. Yakushevich L.V., Savin A.V., Manevich L.V. Nonlinear dynamics of topological solitons in DNA // Phys. Rev. E, vol. 66, pp. 016614(1-14), 2002.
19. Цуркан М.В., Балбекин Н.С., Собакинская Е.А., Панин А.Н., Вакс В.Л. Исследование спектра ДНК методами ТГц спектроскопии // Оптика и спектроскопия, 2013, №6, С.981–986.
20. Шатрова Ю.С., Собакинская Е.А., Вакс В.Л., Панин А.Н. Применение ТГц спектроскопии высокого разрешения для исследования биомолекул // Вестник ННГУ, 2014, №1(2), С.201-205.
21. Vaks V.L., Domracheva E.G., Pripolzin S.I., Sobakinskaya E.A., Сhernyaeva M.B., Anfert’ev V.A., Semenova A.V., Shatrova Yu.S. Methods and Instruments of High-Resolution Transient THz Spectroscopy for Diagnostics of Socially Important Diseases // Phys. Wave Phen., vol. 22, pp. 177–184, 2014.