ТРАДИЦИОННЫЕ МЕТОДЫ НАГРЕВА В ПРИМЕНЕНИИ К МАГНИТНО-РЕЗОНАНСНОЙ ТЕРМОМЕТРИИ
А. А. Волков1,2, С.К. Какагельдыев2, А.С. Прохоров1, Ю. А. Пирогов2
1Институт общей физики имени А.М. Прохорова РАН, г. Москва
2Центр магнитной томографии и спектроскопии
МГУ имени М.В. Ломоносова, г. Москва
Получена 17 января 2012 г.
Аннотация. Рассматривается возможность и целесообразность использования в системах магнитно-резонансной термометрии традиционных методов нагрева – диффузии тепла от миниатюрных электронагревателей. Описываются методики совмещения электропроводящих источников тепла (нагревателей из высокоомного провода) с МРТ аппаратурой и наблюдения тепловых эффектов, вызванных их нагревом. На модельных объектах демонстрируется пространственно-временная динамика артефактов, исходящих от материала нагревательного элемента и магнитного поля электрического тока.
Ключевые слова: магнитно-резонансная томография (МРТ), магнитно-резонансная термометрия, МРТ температурный мониторинг, бесконтактная регистрация температурных полей.
Abstract. The capabilities and expediency of using traditional methods of heating – thermo diffusion from mini electric heaters for systems of MR thermometry is investigated. Methods of combine use of conductive sources of heat (electric heaters, based on high-resistant wire) with MRI equipment and methods of real time monitoring of thermal effects, caused by heating, are described. Spatio-temporal dynamics of metal artefacts, inducted by material of electric heaters and their magnetic fields is demonstrated on model objects.
Key words: Magnetic-resonance imaging (MRI), MR-thermometry, non-invasive thermometry, MRI temperature mapping.
1. Введение
В современной медицинской диагностике широко используются методы магнитно-резонансной томографии (МРТ). В штатном режиме МРТ позволяет бесконтактно, с высокими скоростями и пространственным разрешением до 0.1 мм получать трехмерные изображения внутренних структур исследуемых объектов. Быстро увеличивается парк современных высокоэффективных томографов, на базе которых развивается освоение новых исследовательских методик. На этом фоне явно отстает разработка методов регистрации в исследуемых средах тепловых полей, имеющих естественное или искусственное происхождение. В этой связи МРТ-мониторинг температурного контраста видится исключительно удобным способом наблюдения тепловых процессов внутри объекта и инструментом обратной связи, регулирующим тепловое воздействие и отвечающим на вопрос о его эффективности. В сравнении с контактными методами контроля тепла, использующими термозонды (полупроводниковые болометры, изменяющие в зависимости от температуры проводимость), МРТ-метод помимо своего главного положительного свойства неинвазивности предполагает многократно расширенный охват исследуемого пространства.
Особенностью метода МРТ
по сравнению с другими бесконтактными методиками (рентгеновскими и
ультразвуковыми) является его чувствительность к температуре. В той или иной
степени от температуры зависят: время спин-решеточной релаксации Т1
[1-2],время спин-спиновой релаксации Т2 [3], протонная
плотность (намагниченность) М0 [4], коэффициент диффузии D
[5] и химический сдвиг δ [6,7,9]. В последние годы предложен ряд
вариантов использования этих факторов в применении к магнитно-резонансной (МР),
или в частности к МРТ-термометрии. Регистрация изменения, например,
коэффициента самодиффузии в зависимости от температуры позволяет достигать
термочувствительности 0.2![]() при объеме воксела 0.3 см3. По изменению фазы МРТ
сигнала изменение температуры регистрируют с точностью лучше 1
при объеме воксела 0.3 см3. По изменению фазы МРТ
сигнала изменение температуры регистрируют с точностью лучше 1![]() при объеме воксела 0.05 см2 и временном разрешении
менее 10 секунд [8].
при объеме воксела 0.05 см2 и временном разрешении
менее 10 секунд [8].
МРТ-термометрия в условиях
медицинского применения – сложная техническая задача по той принципиальной
причине, что нужные для гипертермии температурыпредельно высоки для простой и
уверенной регистрации сигнала ЯМР. В области рабочих температур 30-45![]() процесс ЯМР находится в режиме энергетического насыщения:
заселенности расщепленных магнитным полем зеемановских уровней близки по
величине, отношение заселенностей составляет всего 10-6, и ЯМР
сигнал требует многократного усиления. Это при том, что для клинической
практики требуется регистрация температурных изменений, лежащих в пределах
всего нескольких процентов абсолютной величины при разрешении до десятых долей
градуса. Кроме этого, зондируемая в методе МРТ спиновая подсистема имеет
принципиально слабую связь с носителем температуры – атомно-молекулярным
остовом ткани (термостатом). В применении к реальной клинической практике метод
осложняется перфузией в кровеносных сосудах и изменением уровня насыщения крови
кислородом.
процесс ЯМР находится в режиме энергетического насыщения:
заселенности расщепленных магнитным полем зеемановских уровней близки по
величине, отношение заселенностей составляет всего 10-6, и ЯМР
сигнал требует многократного усиления. Это при том, что для клинической
практики требуется регистрация температурных изменений, лежащих в пределах
всего нескольких процентов абсолютной величины при разрешении до десятых долей
градуса. Кроме этого, зондируемая в методе МРТ спиновая подсистема имеет
принципиально слабую связь с носителем температуры – атомно-молекулярным
остовом ткани (термостатом). В применении к реальной клинической практике метод
осложняется перфузией в кровеносных сосудах и изменением уровня насыщения крови
кислородом.
Проблемой остаётся доставка тепла в область терапии [13]. Наиболее удобным и востребованным методом создания температурных полей внутри объекта является лазерный. Прямой фокусировкой излучения на ткань или с помощью световодов можно реализовать режим теплового разложения ткани (режим термоабляции). Режущая способность лазерного излучения, однако, резко падает при отстройке частоты от линии поглощения воды, что позволяет использовать аппаратуру в режиме гипертермии. Даже номинально мощные потоки излучения с длинами волн 0,81 мкм (полупроводниковые лазеры) и 1,07 мкм (лазеры на алюминий-иттриевом гранате с неодимом, АИГ:Nd) дают менее интенсивный нагрев, слабо зависящий от вида биологической ткани. Именно эти методы, способные обеспечить медленный локальный нагрев, составляют сегодня основу технического парка лазерной гипертермии [10]. В биологических средах эффективность поглощения излучения в высокой степени пространственно анизотропна, по причине чего задача точной доставки тепла в рабочую область всегда конкретна и не имеет общего решения.
2. Модель термодиффузии для МРТ термометрии
Разнообразие режимов работы МРТ-систем и наблюдаемых с их помощью эффектов создает широкий фронт поиска оптимальных путей реализации гипертермии. Задача сложна, прежде всего, своей многопараметричностью. Одним из направлений её решения может быть изучение ЯМР-мониторинга тепловых процессов в условиях существенного упрощения задачи посредствам моделирования. На первом этапе целесообразно использование взамен реальных тканей биологических фантомных образцов с одновременным применением вместо лазерных систем максимально простых и доступных методов нагрева. Это позволяет, с одной стороны, создавать и наблюдать температурные эффекты в удобных для МРТ режимах и, с другой стороны, обрабатывать экспериментальные данные с помощью математических моделей в строго определенных приближениях.
Базовой моделью для
гипертермии служит модель термодиффузии тепла. Задав граничные условия
эксперимента, систему можно точно описать моделью в рамках классического
представления о распространении тепла на основе линейного уравнения
теплопроводности, которое устанавливает связь между временным и
пространственным изменением температуры в любой точке поля ![]() :
:
![]() +q,
(1)
+q,
(1)
где a = χ/(cρ), χ – коэффициент температуропроводности, с – теплоемкость и ρ – плотность вещества, q – функция источника [10].
Этот подход используется во многих приложениях. Наиболее часто в подобных исследованиях в качестве калиброванных источников тепла успешно применяются нагреватели из высокоомных проводников, с помощью которых создаются температурные градиенты различных конфигураций. Таким способом имитируются и моделируются самые разнообразные тепловые процессы, доступные для математического описания. Аппаратурные и методические наработки могли бы в полной мере применяться в МРТ-томографии, но сам принцип работы этого метода – непременное использование сильного магнитного поля – создает специфическую проблему учета искажений этого поля присутствием в нем электропроводящих материалов и протекающих в них токов. Возможность применения металлосодержащих сред и традиционных методов нагрева в МРТ-методе неочевидна и требует направленных исследований.
В клинической практике утвердилось мнение, что присутствие металлических объектов в организме пациента (импланты, протезы и пр.) является губительным для МРТ контраста фактором. В этих случаях наблюдаются серьезные искажения (артефакты) изображений, вызванные неоднородностью магнитного поля в области нахождения металлосодержащего объекта, локальными завихрениями линий магнитной индукции и эффектами РЧ экранирования. Наиболее серьезный вклад в формирование артефактов создают неоднородности поля. Чрезмерно большие его градиенты вблизи металла повышают внутривоксельную расфазировку и сильно сокращают время поперечной релаксации Т2, что приводит к перекрытию сигналов с разными фазами (разное время TE). В этих условиях спасительным оказывается применение последовательностей спинового эха, которые рефокусируют расфазированные спиновые моменты. В присутствии металла, однако, такие последовательности сильно страдают от пространственных артефактов, требуя нелинейного частотного позиционирования. При отсутствии неоднородностей поля пространственная локализация спинов, детерминированная частотной компонентой их прецессии, является линейной функцией, которая определяется амплитудой градиента. Когда объект исследования содержит металл, неоднородность магнитного поля влияет на частоту градиента, в результате чего пространственная локализация спинов становится сильно нелинейной. Затрудняются частотное кодирование и срез-селективная регистрация сигнала во время сканирования.
Наиболее эффективным на сегодня признан так называемый VAT-метод (View-Angle-Titling), позволяющий снижать искажение в плоскости среза за счет использования дополнительного градиента по оси. Добавление z-фазы кодирования к методу VAT значительно ускоряет процесс. Одновременно удается детектировать сигнал и по перпендикулярной срезу оси. Тем самым, становится возможным определять и восстанавливать объективное пространственное распределение спинов в объеме [11, 12]. В литературе можно встретить много примеров успешного решения задач МРТ-сканирования при работе с привычными для медицины токопроводящими материалами – титаном, хирургической сталью, металлокерамикой. Однако все они, как правило, узкоспециализированы и содержат в своей основе эмпирический подход. Общие закономерности совместимости-несовместимости металлов с МРТ аппаратурой и фундаментальные причины происхождения артефактов целенаправленным исследованиям пока не подвергались.
3. Эксперимент
В настоящей работе исследовались томографические Т1 релаксационные карты модельных фантомов с введенными в них электронагревателями из высокоомной проволоки, с помощью которых в фантомах создавались локальные тепловые поля разной интенсивности и конфигурации. Целью ставилось наблюдать временную динамику продольной релаксации Т1 в зависимости от температуры, выяснить степень влияния проводящей среды нагревателя на однородность магнитного поля катушки и, соответственно, на точность измерений, получить представление о возможности расширенного применения в МРТ методов нагрева тканей на базе электропроводящих нагревателей.
Томографические данные регистрировались на сильнопольном томографе Bruker BioSpec 30/70 с напряженностью поля 7 Тл и частотой магнитного резонанса 300 МГц. Использовалась поверхностная катушка Bruker для малых лабораторных животных (l = 50 мм, D = 35 мм).
Применялись следующие модельные объекты:
Фантом 1 – стеклянная осесимметричная структура (домен из стеклянных трубок, l = 50 мм и D = 5 мм), равномерно наполненная жидкостью. По центру структуры установлен полый стеклянный стержень с навитой на нее проволокой (1 виток для стальной проволоки, D = 0.25 мм, 5 витков для медной проволоки, D = 0.5 мм);
Фантом 2 – стеклянный объем (l = 70 мм, D = 40 мм) с подведенным в центр объема электронагревательным элементом (спираль из нихромовой проволоки NiCr, 20 витков, удельное сопротивление – 0.9 Ом), равномерно заполненный жидкостью.
В качестве наполняющих жидкостей применялись:
1. Дистиллированная вода (для получения опорного сигнала протонов 1H);
2. Жидкий яичный белок (для наблюдения процесса термической коагуляции);
3. Нерафинированное растительное масло, содержащее жирные кислоты: линолиевую (45-60%) и линоленовую (от 15 до 65%) - обязательные компоненты процессов образования клеточных мембран и оболочек нервных волокон.
4. Результаты
В итоге измерений были получены следующие МРТ картины:
1.
Т2-взвешенные изображения фантома 1
(рисунок 1) в присутствии меди (диамагнетик,
![]() = - 0.086·10-9 м3/кг)
и стали (ферромагнетик,
= - 0.086·10-9 м3/кг)
и стали (ферромагнетик, ![]() > 0);
> 0);
2.
Т1-взвешенные изображения фантома 1,
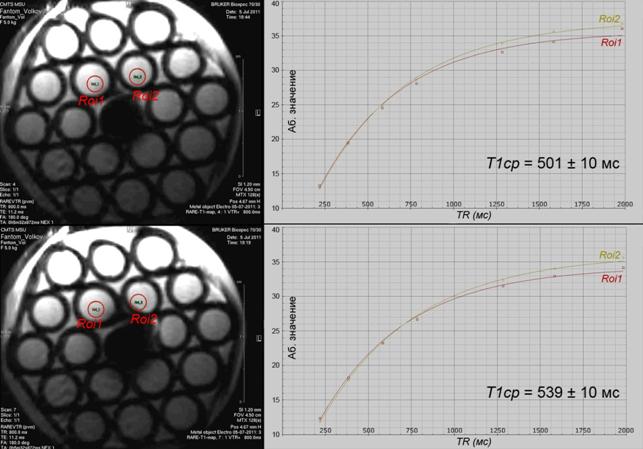
заполненного растительным маслом (рисунок 2) в двух режимах: а) без подачи
тока, и б) при силе тока Iвх = 0.3 А и мощности нагрева P = 1 Вт. Для обоих режимов построены Т1
релаксационные кривые и путем аппроксимации кривой по формуле ![]() вычислены средние для области Roi (D = 1.5 мм) величины времен релаксации Т1:
а) 501 ± 10 мс, б) 539 ± 10 мс;
вычислены средние для области Roi (D = 1.5 мм) величины времен релаксации Т1:
а) 501 ± 10 мс, б) 539 ± 10 мс;
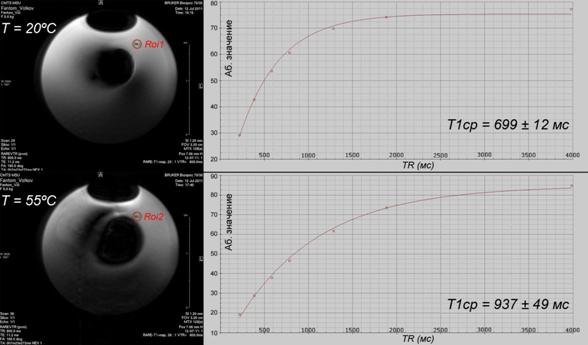
3. Получены температурные зависимости для времени релаксации Т1 для фантома 2, наполненного растительным маслом, с точностью ~ 10% при P = 2.5 Вт (Iвх = 0.5 А), за время 72 минуты (рисунок 3). Т1-взвешенные изображения регистрировались каждые 13 минут. На рисунке 4 представлены результаты до и после нагрева.
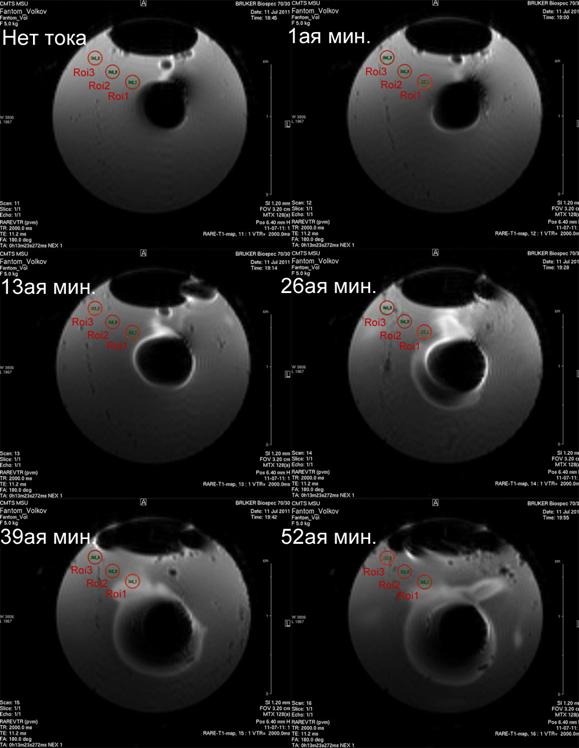
4. Профиль Т1 температурного поля и его динамика для фантома 2, заполненного жидким яичным белком. На рисунке 5 представлена временная динамика профиля в течение 52 минут, при мощности нагрева P = 1 Вт и силе тока Iвх = 0.3 А.
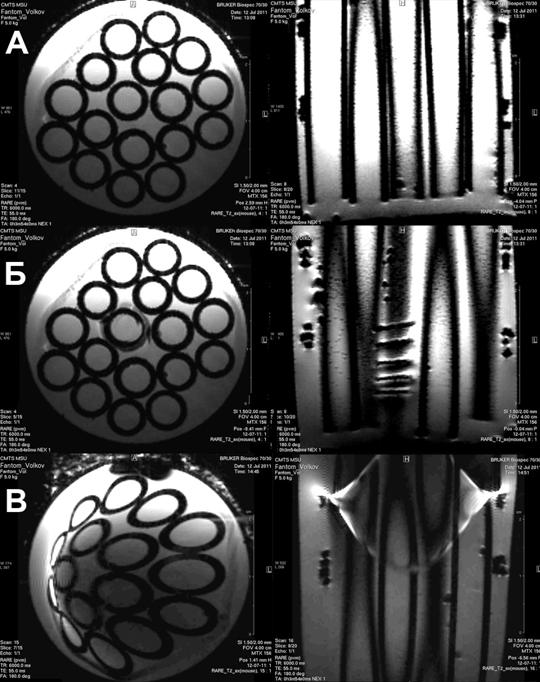
Рисунок 1 – Т2-взвешенные изображения фантома 1, заполненного дистиллированной водой: в аксиальной (слева) и коронарной (справа) проекциях для трех случаев: а) без металла, б) в присутствие медной проволоки, в) в присутствие стальной проволоки. Последовательность: RARE T2, матрица 156, разрешение 0.025 см/пиксел, толщина среза 1.5 мм, TE = 55 мс, TR = 6000 мс.
5. Обсуждение результатов
Присутствие
меди (![]() ≤ 0), как видно из рисунка
1(б), на однородность магнитного поля катушки практически не влияет. В
аксиальной проекции едва заметны искажения поля, локализованные в 2-мм области
вокруг стеклянной трубки с навитой на нее медной проволокой, немного искажен
также круглый контур трубки. В коронарной проекции медная проволока наблюдается
достаточно четко, артефакты проявляются по контуру самой проволоки - чрезмерно
высокий сигнал на границе сред.
≤ 0), как видно из рисунка
1(б), на однородность магнитного поля катушки практически не влияет. В
аксиальной проекции едва заметны искажения поля, локализованные в 2-мм области
вокруг стеклянной трубки с навитой на нее медной проволокой, немного искажен
также круглый контур трубки. В коронарной проекции медная проволока наблюдается
достаточно четко, артефакты проявляются по контуру самой проволоки - чрезмерно
высокий сигнал на границе сред.
Намного ярче искажения поля выражены в присутствие стальной проволоки – рисунок 1(в). В этом случае наблюдаются артефакты пространственного смещения в аксиальной проекции и артефакты-призраки (Ghosteffect) в коронарной проекции.
Как можно было ожидать, наличие парамагнитного материала (стали) внутри объекта исследования привело к появлению в Т2-взвешенных изображениях сильных пространственных артефактов, в то время как присутствие диамагнетика (меди) даже в больших количествах (в 3 раза больших, чем стали), не внесло в картину существенных изменений. Такая разница имеет фундаментальное происхождение. Магнетизм вещества обусловлен тремя причинами: 1) орбитальным движением электронов вокруг атомных ядер; 2) их собственными спинами; 3) спином атомных ядер. Сильными магнитными свойствами (т.е. большой величиной магнитной проницаемости) обладают ферромагнетики Fe, Ni, Co и их сплавы, у которых в состав кристаллической решетки входят атомы с недостроенными внутренними оболочками. В таких материалах при сравнительно малых напряженностях поля H возникают большие индукции B. Связь между этими величинами, вообще говоря, нелинейна из-за явлений насыщения и гистерезиса. Из теоремы о циркуляции магнитного поля:
![]() (2)
(2)
ясно, что именно величина вектора намагничивания, т.е. среднего магнитного момента единицы объема магнетика, создаваемого молекулярными токами Im, при внесении материала в сильное постоянное магнитное поле, может создавать пространственные искажения его однородности.
Таким образом, получаем, что с точки зрения МРТ слабые магнитные материалы в полной мере пригодны для создания нагревательных элементов при условии предварительного выявления создаваемых ими артефактов. В случае сильных магнетиков решение задачи учета искажений проблематично. В простых геометриях восстановление правильной МРТ-картины может быть достигнуто модельной обработкой данных.
Помимо специальных магнитных свойств, вещество нагревательного элемента должно обладать высоким сопротивлением. Наиболее подходящими и самыми популярными в производстве электронагревателей материалами являются металлические сплавы с высоким удельным сопротивлением, в частности, сплавы на основе хрома и никеля (нихром). Нихром, состоящий из Ni (55-78%), Cr (15-23%), Mn (1,5%) и Fe, обладает высокой рабочей температурой (до 1100 °C), высокими значениями плотности ≈ 8500 кг/м3 и механической прочности, имеет удельное сопротивление 1,0 - 1,1·106 Ом·м.
На рис. 2 представлены Т1-взвешенные изображения стеклянной трубки с навитой на нее проволокой из нихрома. Данный материал ведет себя как слабый магнетик. Визуально в аксиальной проекции прослеживаются достаточно четкие и неискаженные контуры стеклянного каркаса. Искажение однородности поля катушки проявляется в пределах всего нескольких миллиметров от нагревательного элемента. При включении тока и соответственно индукции дополнительного магнитного поля Bi существенные артефакты не наблюдаются. Измерения при включенном токе проводились на уровне Iвх = 0.3 А с выделяемой нагревателем мощностью 1 Вт. С целью количественной оценки искажения, внесенного полем Bi, в точках Roi1 и Roi2, локализованных на расстоянии 5 мм от центра нагревателя, до и после нагрева измерялась величина времени Т1 и проводилась оценка величины ошибки измерений.
Полученные экспериментальные данные представлены в таблице 1. Как видно, средняя ошибка измерений (10 мс) до (без артефактов) и сразу после 7-минутного нагрева (в присутствие артефактов) осталась неизменной. Этот факт указывает на то, что степень влияния артефактов на Т1-взвешенные изображения от поля Bi и материала нагревателя достаточно низка и можно говорить о возможности дальнейших экспериментов по гипертермии в рамках данной конфигурации.
Рисунок 2 – Т1-взвешенные изображения фантома 1, наполненного растительным маслом (слева), и соответствующие экспоненциальные кривые Т1 релаксации (справа, для точек Roi1, Roi2) в двух режимах: а) без подачи тока (вверху), б) при Iвх = 0.3 А, P = 1 Вт (снизу), t = 7 минут. Последовательность: RARE T1map, матрица 128, разрешение 0.025 см/пиксел, толщина среза 1.2 мм, TE = 11.2 мс, TR = 2000 мс – 234 мс, 7 циклов.
|
|
Точка измерения |
Время релаксации Т1 |
Ошибка измерения
|
|
Без подачи тепла |
Roi1 |
481мс |
±15мс |
|
Roi2 |
521мс |
±8мс |
|
|
Время нагрева 7 минут, P = 1 Вт |
Roi1 |
500мс |
±12мс |
|
Roi2 |
558мс |
±10мс |
Таблица 1.Экспериментальные данные, полученные для фантома 2 до и сразу после нагрева. P = 1 Вт, Iвх = 0.3 А, t = 7 минут. Последовательность: RARET1map, матрица 128, разрешение 0.025 см/пиксел, толщина среза 1.2 мм, TE = 11.2 мс, TR = от 2000 мс до 234 мс за 7 циклов.
Для определения температурного поведения времени релаксации Т1 фантома 2 были получены Т1-взвешенные изображения с временным шагом в 5 минут во время непрерывного нагрева, т.е. непрерывной подачи тока Iвх = 0.5 А на электронагреватель. На рисунке 3 представлены «сырые» томографические данные до (T0 = 20ºC) и сразу после нагрева (T = 52ºС). Визуально температурные эффекты проявляются в виде локальных изменений интенсивности сигнала.
Рисунок 3 – Т1-взвешенные изображения фантома 2, наполненного растительным маслом (слева) и соответствующие им экспоненциальные кривые Т1-релаксации (справа, для точек Roi1, Roi2) при двух температурах: 20ºС (вверху) и 52 ºС (внизу). Последовательность: RARET1map, матрица 128, разрешение 0.025 см/пиксел, толщина среза 1.2 мм, TE = 11.2 мс, TR = 4000 мс – 234 мс, 7 циклов.
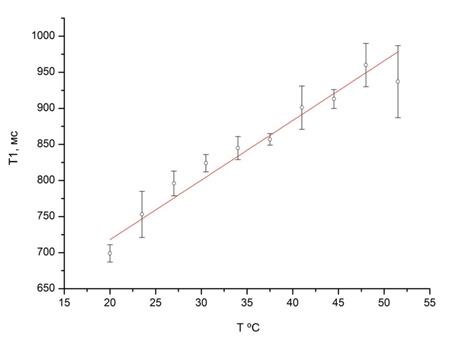
В приближении, что среда изотропна, а температура пропорциональна подаваемой мощности, временная зависимость Т1 была преобразована в функцию температуры. В данных условиях температурная зависимость времени релаксации Т1 имеет линейный ход с ошибкой ±22 мс, соответствующей точности не хуже ±5 % при температурных градиентах порядка 1ºС.
Рисунок 4 – Температурная зависимость времени релаксации Т1 для фантома 2, наполненного растительным маслом: сила тока Iвх = 0.5 А; мощность P = 2.5 Вт; начальная температура T0 = 20 ºC; средняя ошибка S = 22 мс (2,5%); скорость температурного роста Т1 составляет 7 ± 0.2 мс/ºC.
Наблюдение динамики изменения сигнала в ходе нагрева было проведено в эксперименте с использованием сырого яичного белка в качестве заполняющей фантом 2 жидкости. На рисунке 5 приведены томографические данные различных этапов нагрева. Визуально нагрев проявляется в виде пространственных искажений сигнала в окрестности 2-3 мм вокруг нагревательного элемента – области высокого (яркие) и низкого (темные участки) сигнала. Предположительно в этих областях наблюдаются как биологический эффект (структурные изменения вблизи эффекта денатурации), так и температурный эффект увеличения времени продольной релаксации за счет изменения динамики взаимодействия спиновой подсистемы с атомным окружением. На периферийных зонах, в частности, в зоне мениска, также наблюдается динамика, связанная с диффузным движением пузырей воздуха.
Рисунок 5 – Т1-взвешенные изображения фантома 2, заполненного жидким яичным белком, полученные в процессе нагрева (слева – направо – вниз). Мощность нагрева 1 Вт, Iвх = 0.3 А, длительность нагрева 52 минуты. Последовательность: RARE T1 map, матрица 128, разрешение 0.25 мм/пиксел, толщина среза 1.2 мм, TE = 11.2 мс, TR = от 4000 мс до 234 мс за 7 циклов.
6. Заключение
Результаты экспериментов показали, что в МРТ-термометрии возможно применение электронагревателей из высокоомного металла в качестве инструментов доставки тепла. При правильно выбранных режимах подачи тока мониторинг термических эффектов возможен с минимальной долей искажений. Регистрация основных термочувствительных параметров МРТ в таких условиях не выходит за рамки 5% ошибки. Опробованный подход позволяет сопровождать МРТ-мониторинг модельным анализом теплового поля на базе уравнений диффузии тепла, планировать и предсказывать поведение температуры в любой точке объекта. Планируются эксперименты по регистрации и визуализации температурных градиентов разных конфигураций методами Т1 релаксации, диффузии и химического сдвига.
Авторы выражают благодарность Анисимову Н. В. и Никифорову В. Н. за помощь в организации экспериментов и ценные комментарии по поводу полученных результатов.
Литература
1. Dickinson R.J., Hall A.S., Hind A .J., Young I.R. Measurement of changes in tissue temperature using MR imaging// J. Comput. Assist. Tomogr. – 1986. No.10. P.468–472.
2. Kuroda K., Tsutsumi S., Saitoh A. Non-invasive temperature distribution measurement by simultaneous use of multiple NMR parameters// Trans. IEICE . – 1990. J73-A(8). P.1431–1443.
3. Ling C.R., Poster M.A., Hutchison J.M.S. Comparison of NMR water proton T1 relaxation times of rabbit tissues at 24 MHz and 2.5 MHz// Phys. Med. Biol. – 1980. V.25. P.748–751.
4. Simpson J.H., Carr H.Y. Diffusion and nuclear spin relaxation in water// Phys. Rev. – 1958. V.111. P.1201–1202.
5. Hall A.S., Prior M.V., Hand J.W., Young I.R., Dickinson R.J. Observation by MR imaging of in vivo temperature changes induced by radio frequency hyperthermia// J. Comput. Assist. Tomogr. – 1990. V.14. P.430–436.
6. Le Bihan D., Delannoy J., Levin R.L. Temperature mapping with MR imaging of molecular diffusion imaging: Application to hyperthermia// Radiology. – 1989. V.171. P.853–857.
7. Kagayaki Kuroda. Non-invasive MR thermography using the water proton chemical shift// Int. J. Hyperthermia// September 2005. V. 21(6). P. 547–560.
8. Ильясов К.А. Развитие методов магнитно-резонансной томографии в исследовании самодиффузии и температурных полей в живых системах// Дисс. д.ф.м.н.- Казань: Каз.ФТИ РАН, 2011, 280 с..
9. Hall L.D., Talagala S.L. Mapping of pH and temperature distribution using chemical-shift-resolved tomography// J. Magn. Reson. – 1985. V. 65. P.501–505.
10. Волков А.А., Никифоров В.Н., Пирогов Ю.А., Иванов А.В., Прохоров А.С. Регистрация температурного поля методом магнитно-резонансной томографии// Мед. физика. – 2011. № 1 (49). C.75–81.
11. Butts K., Pisani L. Reduction of Blurring in View Angle Tilting MRI with Multiple VAT Readouts// J. Magn. Reson. Med. – 2004. No.11.
12. Wenmiao Lu, Kim Butts Pauly, Garry E. Gold, John M. Pauly, and Brian A. Hargreaves. SEMAC: Slice Encoding for Metal Artifact Correction in MRI// J. Magn. Reson. Med. – 2009. V.62(1). P.66–76.
13. Viola Rieke, Kim Butts Pauly. MR Thermometry// J. Magn. Reson. Imaging. – 2008. V. 27(2). P.376–390.