УДК 537.635
ЛОКАЛЬНАЯ ЯМР-СПЕКТРОСКОПИЯ В ИССЛЕДОВАНИЯХ ИШЕМИИ ГОЛОВНОГО МОЗГА
М. В. Гуляев 1, Л. В. Губский 2, Э. А. Черкашова 2, Н. В. Анисимов 1,
Чжоу Фушан 3, Ю. А. Пирогов 1
1 Московский государственный университет имени М.В.Ломоносова
2 Российский национальный исследовательский медицинский университет имени Н.И.Пирогова, 3 Национальный университет Тайваня
Получена 24 января 2013 г.
Аннотация. Методом локальной ЯМР спектроскопии на 7-Тл биоспектротомографе Bruker BioSpec 70/30 URS изучены морфологические и метаболические особенности ишемических образований в головном мозге крыс. Измерялись протонные спектры тканей головного мозга, которые показали, что после окклюзии средней мозговой артерии образовавшийся ишемический очаг кардинально изменяет метаболические процессы в пораженной области головного мозга: происходит уменьшение креатина, значительное увеличение лактата и липидов, а также возрастание отношения лактат/холин. Эти признаки позволяют с высокой надежностью идентифицировать стадии ишемического перерождения тканей головного мозга после инсульта. Разработанная неинвазивная спектроскопическая методика in vivo в сочетании с режимом МРТ вполне позволяет заменить хирургическую биопсию любых новообразований в организме человека и животных.
Ключевые слова: медицинская физика, магнитно-резонансная томография, радиоспектроскопия ЯМР, ишемия головного мозга, инсульт, биоспектротомограф, метаболиты, биопсия.
Abstract. Morphological and metabolic peculiarities of ischemia formations in the rat head brain were studied by local NMR spectroscopy method on the 7-T biospectral scanner Bruker BioSpec 70/30 URS. Measured proton spectra displayed: after middle brain artery occlusion, formed ischemia seat changes metabolic processes in damage place cardinally. Reduction of kreatine, remarkable increasing lactate and lipids, and growth of lactate/choline relation have place after middle brain artery occlusion. These indications allow with high reliability to determine stages of ischemia regeneration of healthy tissues after brain stroke. Developed noninvasive spectroscopy method in vivo in combination with MRI regime allows to substitute for a surgical biopsy of any new formation in human and animal organisms.
Key words: medical physics, magnetic resonance imaging, NMR radio spectroscopy, head brain ischemia, brain stroke, biospectral MRI scanner, metabolite, biopsy.
1. Введение
При анализе поражения головного мозга полезную информацию дает локальная ЯМР-спектроскопия [1]. Данный метод хорошо зарекомендовал себя при исследовании глиальных опухолей и других онкообразований [2], хотя спектроскопическое изучение ишемических проявлений в структуре головного мозга на должном уровне пока не проводилось. Как было показано в исследованиях по метаболомике in vitro, ЯМР-спектроскопия биофлюидов (плазмы крови, мочи, спинномозговой жидкости, слюны и др.) хорошо дополняет МРТ исследование, поскольку спектральные измерения дают прямую биохимическую информацию, выявляют изменения в метаболизме не только в очаге поражения, но и смежных зонах, а также спинномозговой жидкости [3]. Выявить такие изменения на обычных МРТ-изображениях практически невозможно.
Уже в ранних работах по исследованию ишемии на животных было замечено возрастание пика лактата и снижение уровня креатина, главных метаболитных индикаторов жизнедеятельности головного мозга [4]. Для анализа этих изменений применялась как протонная (1H), так и фосфорная (31P) ЯМР-спектроскопия. Однако при использовании МРТ сканеров того времени степень локализации области интереса (ограниченной объемом более 1 дм3), содержащей относительно малые ишемические участки и определяющей низкое отношение сигнал/шум, была недостаточна для получения устойчивых результатов и утверждения конкретных выводов о метаболическом состоянии ишемически пораженных тканей. И лишь с появлением специализированных исследовательских приборов типа биоспектротомографа BioSpec с магнитным полем 7 Тл и более стало возможным проводить корректные эксперименты по локальной ЯМР спектроскопии малых участков мозга (объемом до нескольких мм3) при инсульте и раковых заболеваниях.
2. Постановка эксперимента и метод локальной ЯМР спектроскопии
В настоящей работе получены данные о метаболитах головного мозга при экспериментальной ишемии мозга у крыс, измеренные методом локальной 1H (протонной) ЯМР-спектроскопии. Информация о локализации очага ишемии определялась по МРТ-изображениям.
Эксперименты проводились в Центре магнитной томографии и спектроскопии (ЦМТС) МГУ на 7-Тл (резонансная частота 300,3 МГц) магнитно-резонансном исследовательском томографе BioSpec 70/30 USR фирмы Bruker (рис.1), оснащенном программными пакетами TopSpin v.2 (для обработки спектральных данных) и ParaVision v.5 (для обработки МРТ-изображений).
В качестве лабораторных животных использовались взрослые крысы «Wistar» весом ~ 400 г. Для наркоза применялась газовая смесь «Форан+кислород», подаваемая с помощью специального оборудования к голове животного. При использовании газовой анестезии смертность животных во время проведения хирургических операций и МРТ экспериментов не наблюдалась. В то же время выход из состояния угнетения крыс составлял не более десяти минут. Для предотвращения переохлаждения животного к платформе, на которой оно располагалось, по гибким трубкам подавалась подогретая вода.

Рис. 1. Внешний вид 7-Тл биоспектротомографа Bruker BioSpec 70/30 URS.
Ишемия мозга вызывалась путем механического перекрытия (окклюзии) правой средней мозговой артерии (СМА) с помощью нейлонового микрофиламента. Спустя 1 час филамент удалялся, проводилось МРТ исследование с определением локализация очага ишемии и снимались локальные спектры ЯМР, относящиеся к этому выделенному участку.
3. Результаты измерений
МРТ-изображения получали с помощью импульсных последовательностей (ИП), дающих Т2-взвешенные изображения (Т2ВИ) - рис. 2. Параметры ИП: TR/TE = 5000/20 мс, ETL = 8, где TR - период повторения РЧ импульсов; ТЕ - время эхо; параметр ETL характеризует ускорение сканирования за счет регистрации нескольких эхо-сигналов на один цикл сканирования. Для получения локальных in vivo 1H спектров ЯМР использовалась ИП PRESS (Point Resolved Spectroscopy). В этой ИП синхронно с РЧ импульсами применяются градиентные поля, что приводит к эффективному уменьшению объема области, на которую воздействуют эти импульсы.
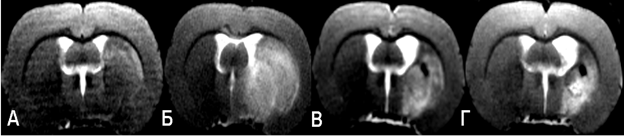
Рис. 2. T2ВИ мозга крысы, полученные с помощью ИП RARE. А, Б, В, Г: сразу после извлечения филамента, спустя 2 дня, 7 и 14 дней после операции соответственно.
Чтобы получить сигналы метаболитов, необходимо подавить мощный сигнал воды (концентрация воды в исследуемом объекте или структуре обычно превышает содержание протонов в метаболитах). Так как интенсивности линий в ЯМР спектрах связаны с концентрацией, водный пик полностью доминирует над протонным спектром.
Для этого реализован частотно-селективный метод подавления сигнала воды. РЧ импульс поворачивает вектор намагниченности протонов воды в поперечную плоскость, на который впоследствии действует дефазирующий градиент. После действия такого градиента поперечная намагниченность воды расфазирована, а продольная еще не успевает восстановиться. В результате после воздействия неселективного 900-ого импульса базовой ИП сигнал воды не формируется.
В настоящей работе сигнал ЯМР принимался из кубика с размером
ребра 2,6 мм - рис. 3. Заметим, что такой объем был соизмерим с объемом
находящейся внутри него ишемически пораженной части головного мозга,
обеспечивая спектральные измерения с максимальным отношением сигнал/шум для
спектральных составляющих, ответственных за метаболизм ишемизированных тканей.
Для достижения высокой однородности поля в выделенной области применялось предварительное
шиммирование именно для этой зоны.
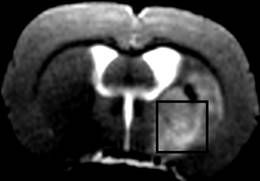
Рис. 3. Мозг крысы (T2ВИ): на коронарном срезе обозначено сечение куба, внутри которого регистрировался сигнал ЯМР.
В спектре протонов (до проведения операции по окклюзии СМА) наиболее отчетливо определялись следующие метаболиты: N-ацетиласпартат (NAA), холин (Cho), креатин (Cr), лактат (Lac), липиды (Lip) – рис.4. Относительное соотношение пиков данных метаболитов дает основание считать мозг крысы здоровым – можно принять данный протонный спектр за эталон (именно таким он должен быть на участках здорового головного мозга).
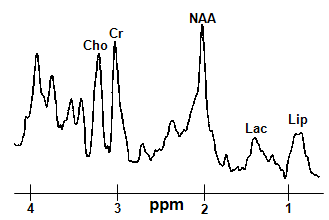
Рис. 4. Локальный 1H ЯМР спектр здоровой области головного мозга крысы.
На рис. 5 представлены локальные in vivo 1H спектры ЯМР, полученные из области ишемии, отмеченной на рис. 3 квадратиком.
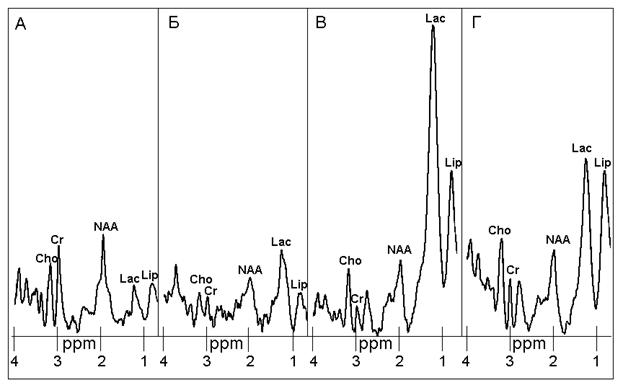
Рис. 5. Локальные 1H спектры в области ишемии. А, Б, В, Г: сразу после окклюзии СМА и спустя 2, 7, 14 дней соответственно.
Как видно из рис. 5, после образования ишемического очага спустя 7 дней можно заметить существенное увеличение спектральной линии Lac. При этом заметно понижение пика Cr относительно Cho. Подобные изменения отмечались также в области инфаркта мозга у людей с ишемическим инсультом [5].
Таким образом, в остром периоде заболевания отмечается существенное увеличение Lac, относительно постоянное содержание NAA и Cho, уменьшение Cr, а также значительное увеличение отношения Lac/Cr в зоне ядра инсульта.
Более подробные спектроскопические исследования различных участков головного мозга показали, что метаболитная карта соответствующих зон в динамике заболевания характеризуется следующими изменениями. В ядре инфаркта происходит снижение концентрации N-ацетиласпартата, холина и креатина в острейшей фазе инсульта (1-2-й дни заболевания, рис. 5 А,Б), после чего (рис. 5 В,Г) амплитуды спектральных линий Cho и NAA стабилизируются приблизительно на исходном уровне; в то же время уровень липидов и лактата увеличивается. В ишемической полутени все метаболиты, за исключением креатинфосфата, имеют тенденцию к повышению, тогда как в морфологически неизмененной ткани головного мозга концентрация всех метаболитов при инсульте снижается.
4. Выводы
Таким образом, локальная 1Н ЯМР-спектроскопия in vivo дает полезную информацию об относительном содержании метаболитов в зоне поражения. Для последующих исследований представляет особый интерес информация о спектрах и в других участках мозга, а также данные ЯМР-спектроскопии ядер, отличных от протонов.
Спектроскопические исследования онкологических новообразований в головном мозге крысы, проведенные в работе [6] по описанной здесь методике, в случае протонных и Р31 спектров ЯМР глиомы С6 обнаружили показатели, адекватные тем, что были получены посредством биопсии.
Следовательно, локальная спектроскопия ЯМР в сочетании с МРТ режимом может служить эффективным способом неинвазивного in vivo определения характера ишемических, онкологических и доброкачественных новообразований и является полноценным аналогом медицинской биопсии, только без хирургического вмешательства.
Работа выполнена при поддержке российско-тайваньского гранта РФФИ № 11-04-92008-ННС_а.
1. Danielsen E.A. Magnetic Resonance Spectroscopy Diagnosis of Neurological Diseases / E.A. Danielsen, B. Ross. NY: Marcel. Dekker, 1999, V. 196, pp. 203-210.
2. Окользин А.В. Магнитно-резонансная спектроскопия по водороду в характеристике опухолей головного мозга// Онкология, 2007, т. 8. [Электронный ресурс]. URL: http://www.medline.ru/oncology.
3. Колоколова Т.Н., Савельев О.Ю., Сергеев Н.М., Шпигун О.А., Соколов К.В., Скворцова В.И. Спектроскопия ядерного магнитного резонанса в решении аналитических задач медицины. Анализ цереброспинальной жидкости // Журнал аналитической химии, 2010, т. 65, № 10, c. 1096-1105.
4. Ligeti L., Osbakken M.D., Subramanian H.V., Kovach A.G., Leigh J.S. Jr., Chance B. 31P and 1H NMR spectroscopy to study the effects of gallopamil on brain ischemia // Magn. Reson. Med., 1987, 4(5), pp. 441-451.
5. Одинак М.М., Труфанов А.Г., Цыган Н.В., Фокин В.А., Вознюк И.А. Магнитно-резонансная спектроскопия в острейшей стадии ишемического инсульта // Кардиология, 2009, т.10 [Электронный ресурс]. URL: http://www.medline.ru/public/pdf/10_025.pdf.
6. Гуляев М.В. Управление контрастом в магнитно-резонансной томографии в полях 0.5 и 7 Тесла// Автореферат диссертации кандидата физ.-мат.наук.- М.: физич. ф-т МГУ, 2012.