УДК 535.343.4, 543.421/.422
НЕСТАЦИОНАРНАЯ ТГЦ СПЕКТРОСКОПИЯ ВЫСОКОГО РАЗРЕШЕНИЯ ДЛЯ РЕШЕНИЯ МЕДИКО-БИОЛОГИЧЕСКИХ ЗАДАЧ
В. Л. Вакс1,2,
Е. Г. Домрачева1,2, Е. А. Собакинская1,2, М. Б. Черняева1,2,
В. А. Анфертьев1,2, А. В. Семенова1,2, Ю. С. Шатрова1,2
1Институт физики микроструктур РАН
2Нижегородский государственный университет им. Н.И.Лобачевского
Статья получена 21 января 2014 г.
Аннотация. Одним из наиболее перспективных методов неинвазивной медицинской диагностики является анализ «запаха» организма, который может использоваться как в целях выявления заболеваний, предсказания реакции организма на конкретный вид лечения, так и для мониторинга эффективности проводимой терапии. На основе измерения концентрации веществ-маркеров в выдыхаемом воздухе можно диагностировать целый ряд серьезных заболеваний, в том числе желудочно-кишечные, онкологические, нервно- психические и ЛОР заболевания. Среди многообразия аппаратурных методов анализа выдыхаемого воздуха наиболее перспективными оказываются спектроскопические методы, наибольший интерес среди которых вызывает спектроскопия терагерцового диапазона (ТГц) частот. Несомненными достоинствами метода газовой нестационарной ТГц спектроскопии высокого разрешения являются высокие чувствительность и разрешающая способность одновременно. В работе представлены результаты спектроскопических исследований выдыхаемого воздуха с применением разработанных ТГц спектрометров для неинвазивной медицинской диагностики диабета, предраковых состояний и онкологических заболеваний органов желудочно-кишечного тракта, мониторинга эффективности проведения лучевой терапии по динамике содержания окиси азота. Изучена тонкая структура спектра ДНК в диапазоне 300-375 ГГц с использованием прецизионного спектрометра на основе синтезатора частоты на лампе обратной волны (ЛОВ) и высокодобротного резонатора.
Ключевые слова: терагерцовый диапазон частот, нестационарная спектроскопия высокого разрешения, неинвазивная медицинская диагностика, выдыхаемый воздух, газ-маркер.
Abstract: One of the most prospective methods of non-invasive diagnostics is the exhaled breath analysis which can be used not only for detecting various diseases and prediction of organism response on concrete medical treatment, but also for monitoring of therapy efficiency. Based on the measuring of gas-markers concentration one can diagnose a number of serious diseases including gastrointestinal, oncological, neuropsychic and ENT diseases. Among the variety of methods of exhaled breath analysis the most prospective are the spectroscopic ones, and namely terahertz spectroscopy. The undoubted advantages of terahertz gas spectroscopy are the high sensitivity and resolution simultaneously. In the paper the results of exhaled breath spectroscopic investigations with using the THz spectrometers developed for non-invasive medical diagnostics of diabetes, pre-cancer states and oncological diseases of gastrointestinal tract, as well as for monitoring the efficiency of radiotherapy on dynamics of ТЩ concentration are presented. The fine structure of DNA spectrum in the frequency range of 300-375 GHz with using the high-precision spectrometer based on BWO frequency synthesizer and high quality resonator was studied.
Key words: terahertz frequency range, high precise non-stationary spectroscopy, non-invasive medical diagnostics, exhaled breath, gas-marker.
Введение
Анализ выдыхаемого воздуха является быстро развивающимся направлением неинвазивной медицинской диагностики. Со времен Гиппократа известно, что выдох пациентов при диабете, болезнях печени и почек, заражении анаэробными инфекциями обладает специфическими запахами. В 1971 году Л.Полинга опубликовал работу [1], в которой с использованием метода газовой хроматографии показал, что в выдыхаемом человеком воздухе помимо азота, кислорода, двуокиси углерода и воды содержится еще более 200 газов. К настоящему времени известно уже более 800 газов, являющихся продуктами физиологических и биохимических процессов в организме. Их концентрация отражает уровень гомеостаза, а также наличие различных патологических состояний [2]. Поэтому анализ выдыхаемого воздуха может применяться в врачебной практике не только для выявления заболеваний, предсказания реакции организма на конкретный вид лечения, но и для мониторинга эффективности проводимого лечения. Диагностика на основе анализа выдыхаемого воздуха имеет ряд преимуществ по сравнению с традиционно применяемыми методами. Анализ газовой смеси безопасен для персонала, поскольку не связан с необходимостью работы с биологическими жидкостями. Он относительно дешев, занимает немного времени и позволяет обнаруживать детектируемые вещества в минимальных концентрациях. Исследование выдыхаемого воздуха можно рассматривать как идеальный метод мониторинга, поскольку он не предполагает инвазивных вмешательств и может проводиться с любой кратностью, создавая возможности для тщательного изучения динамики физиологических процессов.
К современным методам исследования состава выдыхаемого воздуха [2] относятся газовая хроматография [3,4], масс-спектрометрия, совмещенная с газохроматографическим разделением [5,6], электрохимические сенсоры [7], УФ-хемолюминесценция [8], которые, в основном, являются инвазивными. Среди многообразия аппаратурных методов анализа выдыхаемого воздуха наиболее перспективными оказываются спектроскопические методы, например, фотоакустическая спектроскопия [9], диодно-лазерная спектроскопия поглощения [10]. Наибольший интерес вызывает спектроскопия терагерцового (ТГц) и субтерагерцового (субТГц) диапазонов частот [11-13].
1. Методы и приборы ТГц нестационарной спектроскопии
Несомненными достоинствами методов газовой нестационарной спектроскопии терагерцовой (ТГц) частотного диапазона, развиваемых в ИФМ РАН, являются высокие чувствительность и разрешающая способность одновременно. К достоинствам также относятся высокая информативность спектроскопического сигнала, возможность дистанционного неинвазивного контроля многокомпонентных газовых смесей, дающего информацию о реальном содержании примесей в исследуемом газе. Процесс приготовления образца к измерениям не имеет особых технологических трудностей и представляет собой откачку исследуемого объема до рабочего давления порядка 0.05 Торр и напуск газов. Для высокочувствительного анализа, который можно проводить в режиме реального времени, достаточно малого количества исследуемого вещества. Аналитические спектральные линии известных молекул не перекрываются между собой – это позволяет проводить измерения практически при любых возможных сочетаниях компонентов в газовых смесях [14].
В ИФМ РАН разработано и реализовано семейство газовых спектрометров субТГц и ТГц диапазонов, в качестве источника излучения которых использованы синтезаторы частот на основе ламп обратной волны (ЛОВ) и твердотельных генераторов миллиметрового диапазона длин волн с умножителем частоты на полупроводниковых сверхрешетках (ПСР) [15]. Приемная система спектрометра на основе нестационарных эффектов работает в таком режиме, когда на вход детектора (смесителя) приходят одновременно два сигнала: сигнал свободно затухающей поляризации от исследуемых молекул и излучение от генератора, которое на резонансной частоте молекулярного поглощения взаимодействовало с молекулами. При этом от детектора (смесителя) требуется высокое быстродействие, связанное с необходимостью регистрировать процессы молекулярной релаксации, следующие с высокой частотой повторения [15].
В настоящей работе мы представляем результаты применения нестационарных спектрометров субТГц и ТГц диапазонов для решения ряда задач неинвазивной медицинской диагностики:
• контроль изменений концентрации маркеров диабета 2-го типа (CH3COCH3, CH3OH, C2H5OH);
• выявление маркеров предраковых состояний и онкологических заболеваний органов ЖКТ;
• контроль изменений концентрации NO в выдыхаемом воздухе при проведении лучевой терапии;
• контроль изменений концентрации NH3 при заболеваниях ЖКТ.
2. Исследование спектров поглощения газов-маркеров диабета
Были проведены исследования вращательных спектров поглощения ацетона, метилового и этилового спиртов в выдыхаемом воздухе у 8 условно здоровых людей и 9 больных диабетом (до и после приема лекарств) в диапазоне 118-178 ГГц (рис. 1-3). Исследования показали повышенное содержание ацетона в выдохе пациентов с диабетом по сравнению со здоровыми людьми. Кроме того, выявлена динамика изменения концентрации ацетона до и после приема лекарств. При этом было отмечено незначительное изменение концентрации спиртов в выдохе.
Таблица 1. Концентрация ацетона в выдыхаемом воздухе условно здоровых добровольцев и пациентов с диабетом
|
№ |
Концентрация ацетона, об.% |
|
|
Условно здоровые добровольцы |
Пациенты с диабетом |
|
|
1 |
0,00009035 |
0,0035235 |
|
2 |
0,00019089 |
0,00246543 |
|
3 |
0,0002212 |
0,0027356 |
|
4 |
0,0001413 |
0,0015657 |
|
5 |
0,0001356 |
0,00436598 |
|
6 |
0,00011723 |
0,00264582 |
|
7 |
0,00016187 |
0,00326512 |
|
8 |
0,00017312 |
0,00314152 |
|
9 |
0,002978145 |
|
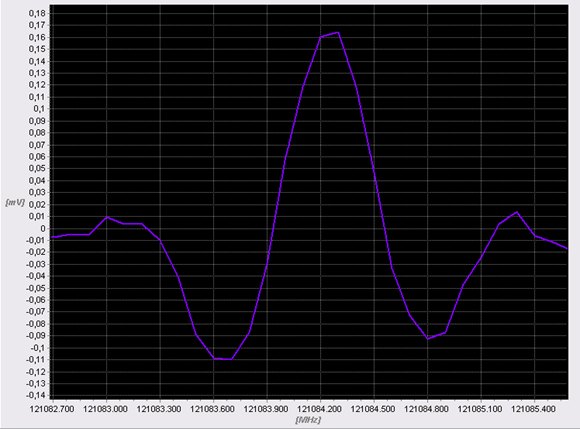
Рис. 1. Запись линии поглощения ацетона в выдохе больного диабетом 2-го типа.
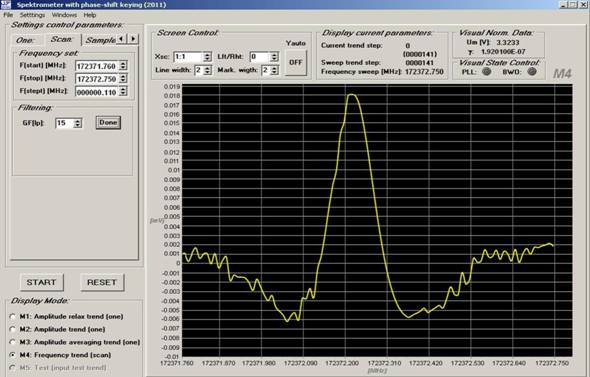
Рис. 2. Запись линии поглощения этанола в образце выдыхаемого воздуха больного диабетом
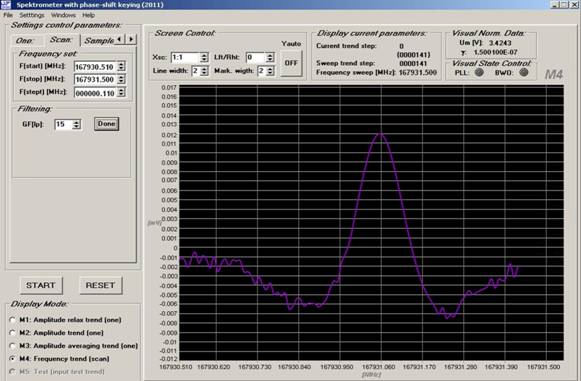
Рис. 3. Запись линии поглощения метанола на частоте f=167,931 ГГц в образце выдыхаемого воздуха больного диабетом
3. Выявление газов-маркеров предраковых состояний и онкологических заболеваний органов желудочно-кишечного тракта
Были проведены исследования по выявлению веществ-маркеров предраковых состояний и онкологических заболеваний органов желудочно-кишечного тракта с целью проведения скрининговой диагностики по выдыхаемому воздуху и с использованием эндоскопического забора воздуха непосредственно из органа. В частности, в клинических условиях при исследовании выдыхаемого воздуха и эндоскопической пробы из желудка были зарегистрированы линии поглощения ряда веществ (C4H9CN, C6H5CN, C3H7CN, HC2CHCHCN) (рис. 4), которые могут служить потенциальными маркерами аденокарциномы желудка.
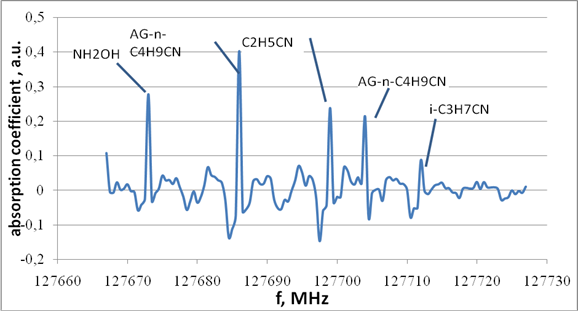
Рис. 4. Запись участка спектра поглощения веществ-маркеров аденокарциномы желудка
4. Изучение динамики содержания окиси азота в выдохе больных онкологическими заболеваниями легких
В клинических условиях были проанализированы образцы выдыхаемого воздуха пяти условно здоровых некурящих добровольцев и 8 онкологических больных (лимфома Ходжкина, центральный эндобронхиальный рак легкого) до и после лучевой терапии. Забор пробы осуществлялся непосредственно перед сеансом лучевой терапии, а затем сразу после сеанса. Результаты измерений представлены в таблице 2. Отмечена низкая концентрация NO в выдыхаемом воздухе у здоровых лиц и рост данного вещества у онкологических больных. Измерение концентрации NO проводилось не с целью диагностики рака легкого, а с целью изучения динамики его содержания в выдыхаемом воздухе до и после сеанса лучевой терапии у больных, которым проводилось облучение зоны средостения и легочной ткани по поводу различных онкологических заболеваний (рак легкого, лимфома Ходжкина). Полученные данные показали существенное (в 2-5 раз) возрастание содержания NO непосредственно после облучения, что подтвердило гипотезу о роли данного соединения в развитии радиационно-индуцированного повреждения биологических тканей [11].
Таблица 2. Концентрация NO в выдыхаемом воздухе условно здоровых добровольцев и онкологических пациентов
|
№ |
Концентрация NO до проведения лучевой терапии, об.% |
Концентрация NO после проведения лучевой терапии, об.% |
|
Условно здоровые добровольцы |
||
|
1 |
0,00717±0,00036 |
|
|
2 |
0,00538±0,00027 |
|
|
3 |
0,00747±0,00037 |
|
|
4 |
0,00329±0,00017 |
|
|
5 |
0,00327±0,00016 |
|
|
Лимфома Ходжкина, II стадия |
||
|
1 |
0,012±0,0006 |
0,022±0,0011 |
|
2 |
0,0149±0,00075 |
0,0254±0,0013 |
|
Центральный эндобронхиальный рак легкого, III стадия |
||
|
1 |
0,018±0,0009 |
0,075±0,00375 |
|
2 |
0,015±0,00075 |
0,034±0,0017 |
|
3 |
0,0179±0,0009 |
0,0747±0,00374 |
|
4 |
0,0149±0,00075 |
0,0335±0,00168 |
|
5 |
0,0254±0,0013 |
0,0508±0,00254 |
|
Центральный эндобронхиальный рак легкого, IV стадия |
||
|
1 |
0,12±0,006 |
0,224±0,0112 |
5. Изучение динамики концентрации NH3 при инфицировании бактерией Helicobacter pylori
Производились измерения концентрации аммиака в выдыхаемом воздухе пяти пациентов, инфицированных бактерией Helicobacter pylori (скрининговый тест), а также в пробах воздуха, забираемой с помощью специального эндоскопического оборудования непосредственно из желудка этих пациентов. Последняя процедура ставит своей целью не просто подтверждение наличия в желудке микроорганизма, но и высокоточную диагностику локализации Helycobacter, что весьма важно для назначения лечения и прогноза заболевания. Измерения концентраций аммиака проводились в диапазонах 115-178 ГГц. Также в клинических условиях были проведены исследования выдыхаемого воздуха у трех условно здоровых некурящих добровольцев с целью определения уровня концентрации аммиака здорового человека. Результаты исследований выдыхаемого воздуха приведены в Таблице 3 [11]. Отмечено повышенное содержание аммиака в образцах выдыхаемого воздуха и эндоскопических проб пациентов, инфицированных Helicobacter pylori, по сравнению с образцами условно здоровых добровольцев.
Таблица 3. Концентрация NH3 в выдыхаемом воздухе условно здоровых добровольцев и инфицированных Helicobacter pylori
|
No |
Концентрация аммиака, об.% |
|
|
Условно здоровые добровольцы |
Больные (Helicobacter pylori ) |
|
|
1 |
0,00098651 |
0,00905624 |
|
2 |
0,001045328 |
0,00751254 |
|
3 |
0,00087523 |
0,0100415 |
|
4 |
0,00764129 |
|
|
5 |
0,008743 |
|
6. Изучение спектра ДНК в ТГц диапазоне частот
Другим направлением работ являлось изучение спектра ДНК в ТГц диапазоне частот. Спектроскопическая информация, выявляющая особенности тех или иных молекул, может быть полезна для понимания и управления биохимическими процессами, а также для медицинской диагностики на клеточном и молекулярном уровнях. Авторами была разработана и реализована экспериментальная установка для прецизионных спектральных измерений, а также изучен спектр ДНК в ТГц диапазоне частот. Были проведены подробные исследования в диапазоне 300-375 ГГц с использованием прецизионного спектрометра на основе синтезатора частоты на ЛОВ и высокодобротного резонатора, что позволило добиться высокой стабильности сигнала и спектрального разрешения менее 10 кГц. В спектре поглощения ДНК во всем диапазоне работы синтезатора на ЛОВ, 300-375 ГГц, с шагом 3 ГГц и 200 МГц были выявлены следующие спектральные области, характеризующиеся наиболее сильным поглощением, 306 ГГц, 315 ГГц, 324 ГГц, 333 ГГц, 348ГГц, 360ГГц (рис. 5).
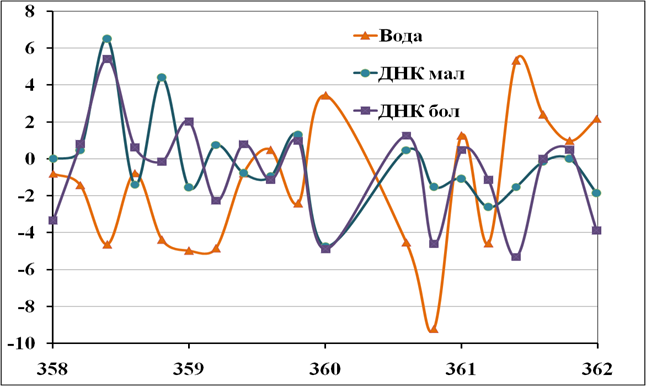
Рис. 5. Спектр воды и ДНК (в двух концентрациях), записанный с шагом 200 МГц в диапазоне 358-362 ГГц
7. Выводы
Спектроскопическое исследование выдыхаемого воздуха и
«запахов» тканей в ТГц диапазоне частот может стать эффективным методом
неинвазивной интегральной диагностики состояния организма, воспалительных
процессов и последствий терапевтического и радиационного воздействия с помощью
анализа выдыхаемого воздуха и тканей. Могут быть диагностированы следующие
заболевания: предраковые состояния и онкологические заболевания органов
желудочно-кишечного тракта, гастрит, гастродуоденит, холецистит, панкреатит,
диабет, ЛОР-заболевания, болезни молочной железы, доброкачественные и
злокачественные опухоли, рак легкого и др.. Развитый метод ТГц спектроскопии, основанный на применении
стабильных по частоте источников излучения и высокодобротного резонатора,
позволяет изучать тонкую структуру сложных спектров биомолекул, что дает
возможность практического использования полученных результатов для решения
биологических задач.
Работа выполнена при поддержке Программы Президиума РАН
«Фундаментальные науки – медицине», а также Гранта
Правительства Российской Федерации № 11.G34.31.0066 и TeraDec, проекта 047.018.005.
Литература
1. Linus Pauling, Arthur B. Robinson, Roy Teranishi, and Paul Cary, Quantitative Analysis of Urine Vapor and Breath by Gas-Liquid Partition Chromatography // Proc. Natl. Acad. Sci. USA. 68(10), p. 2374-2376 (1971).
2. Степанов Е.В. Диодная лазерная спектроскопия и анализ молекул-биомаркеров // М.: Физматлит, 2009.
3. Kage S., Kudo K., Ikeda N. Determination of nitrate in blood by gas chromatography and gas chromatography-mass spectrometry.// Journal of Chromatography - Biomedical Applications. 742(2), p. 363-368 (2000)
4. Larstad M., Loh C., Ljungkvist G., Olin A.C., Toren K. Determination of ethane, pentane and isoprene in exhaled air using a multi-bed adsorbent and end-cut gas-solid chromatography // The Analyst. 127(11), p. 1440-1445 (2002)
5. Michael Phillips, Kevin Gleeson, J Michael B Hughes, Joel Greenberg, Renee N Cataneo, Leigh Baker, W Patrick McVay, Volatile organic compounds in breath as markers of lung cancer: a cross-sectional study // The Lancet 353(9168), p. 1930-1933 (1999)
6. Volatile biomarkers in the breath of women with breast cancer // J. Breath Res. 4(2) p.026003(1-8) (2010)
7. Stetter J.R., Penrose William R., and Yao Sh. Sensors, Chemical Sensors, Electrochemical Sensors, and ECS // Journal of The Electrochemical Society. 150(2), p. S11-S16 (2003)
8. Garcia-Campana A.M., Baeyens W.R.G. Chemiluminescence in analytical chemistry // Marcel Dekker, Inc, 2001.
9. Pushkarsky M.B., Webber M.E., Patel C.K.N. Ultra-sensitive ambient ammonia detection using CO2-laser-based photoacoustic spectroscopy // Applied Physics B: Lasers and Optics. 77(4), p. 381-385 (2003)
10. Yan W.-B. Trace gas analysis by diode laser cavity ring-down spectroscopy.// Test and Measurement Applications of Optoelectronic Devices, Proc. SPIE. 4648, p. 156-164 (2002)
11. Vaks V.L., Brailovsky A.B., Khodos V.V. Millimeter Range Spectrometer with Phase Switching – Novel Method for Reaching of the Top Sensitivity // Infrared & Millimeter Waves. 20(5), p. 883-896 (1999)
12. Vaks V.L., Khodos V.V., Spivak E.V. A nonstationary microwave spectrometer // Review of Scientific Instruments. 70(8), p. 3447-3453 (1999)
13. Khodos V.V., Ryndyk D.A., Vaks V.L. Fast passage microwave molecular spectroscopy with frequency sweeping // Eur.Phys.J.Appl.Phys. 25, p. 203-208 (2004)
14. Вакс В.Л., Домрачева Е.Г., Никифоров С.Д., Собакинская Е.А., Черняева М.Б. Применение микроволновой нестационарной спектроскопии для неинвазивной медицинской диагностики // Известия Вузов. Радиофизика. 51(6), с. 490-498 (2008)
15. V.L.Vaks, High-Precise Spectrometry of the Terahertz Frequency Range: The Methods, Approaches and Applications // Journal of Infrared, Millimeter and Terahertz Waves. 33(1), p. 43-53 (2012)
16. Gallagher J.J., Bedard F.D., Johnson C.M. Microwave spectrum of 14N16O // Physical Review. 93(4), p. 729-733 (1953).