УДК 537.635
Новый двумодальный контрастный агент для магнитно-резонансной томографии
А. В. Шибаев1, Л. Л. Гервиц2, О. Е. Филиппова1, М. В. Гуляев1, Н. В. Анисимов1, Ю. А. Пирогов1, А. Р. Хохлов1
1 Московский государственный университет имени М.В.Ломоносова
2 Институт элементоорганических соединений РАН
Статья поступила в редакцию 1 марта 2016 г.
Аннотация. В работе получен новый контрастный агент на основе фторуглеродной эмульсии. Показано, что он обладает таким же коротким временем релаксации Т1 протонов, что и коммерческий контрастный агент Омнискан®, и в то же время дает сильный ЯМР сигнал на ядрах 19F. Благодаря этим свойствам, разработанный контрастный агент перспективен для получения совместных 1H и 19F-МРТ-изображений в магнитно-резонансной томографии.
Ключевые слова: магнитно-резонансная томография, спектроскопия ЯМР, фторуглеродные соединения.
Abstract. In the paper, a new contrast agent based on fluorocarbon emulsion was prepared. It has the same shot T1-relaxation time of protons as commercial contrast agent Omniscan®, and at the same time it provides a strong NMR signal on 19F nuclei. Due to these properties, the elaborated agent is promising for simultaneous 1H and 19F magnetic resonance imaging.
Key words: magnetic resonance imaging, NMR spectroscopy, fluorocarbons.
Введение
Магнитно-резонансная томография (МРТ) является одним из наиболее распространенных методов медицинской диагностики [1]. В настоящее время МРТ-диагностика проводится в основном на протонах, так как атомы водорода содержатся в воде и органических молекулах, составляющих основу живых тканей. Другие атомы, и в частности, фтор, также могут быть востребованы в МРТ-диагностике, например, при введении в организм фторсодержащего препарата, когда необходимо выявить его локализацию. Поскольку гиромагнитные отношения фтора и протона близки, то сигнал фторного ЯМР сопоставим с протонным. Но атомов фтора практически нет в живых организмах и они дают пренебрежимо малый вклад в структуру биологических объектов. Поэтому на 19F-МРТ-изображениях внутренних органов человека и животных отсутствуют фоновые сигналы от нормальных тканей, которые обычно создают сложности в протонном МРТ.
Весьма перспективным выглядит создание фторсодержащих контрастных агентов, имея в виду регистрацию эффекта от их воздействия как на протонных МРТ-изображениях, так и на фторных. Это существенно повышает информативность метода МРТ для визуализации внутренних органов. Основой таких двумодальных контрастных агентов могут быть водные эмульсии перфторуглеродов и применяемые в протонном МРТ парамагнетики на основе ионов гадолиния (Gd3+) [2–5].
Эффект воздействия парамагнитного агента состоит в том, что его проникновение в зону интереса приводит к сокращению времени продольной релаксации в этой зоне. А это, в свою очередь, приводит к повышению сигнала на T1-взвешенных изображениях. Необходимо отметить, что, хотя многие соли Gd3+ растворимы в воде, их непосредственно не используют в качестве контрастных агентов, так как образующиеся в результате их диссоциации свободные ионы Gd3+ токсичны преимущественно из-за их положительного заряда, вызывающего взаимодействие с противоположно заряженными мембранами клеток. Уменьшить токсичность можно, окружив ионы Gd3+ хелатной оболочкой. В связи с этим в медицине ионы Gd3+ применяются как контрастные агенты именно в виде хелатов.
Цель работы состояла в создании двумодального контрастного агента на основе перфторуглерода и хелата гадолиния, с помощью которого можно регистрировать эффект от его проникновения в исследуемый орган как на протонном, так и фторном МРТ-изображениях. В качестве препарата, содержащего хелат гадолиния, был выбран Омнискан®, основу которого составляет гадодиамид. В качестве перфторуглерода использован перфтортрибутиламин (ПФТБА) [6-8]. Он весьма перспективен для применения в МРТ, поскольку содержащийся в нем перфторуглерод имеет три магнитно-эквивалентные трифторметильные группы. Для обеспечения наилучшего контрастирования ионы Gd3+ должны находиться на поверхности капель перфторуглерода, чтобы, с одной стороны, иметь непосредственный контакт с водой (и воздействовать на ЯМР-сигнал протонов), а с другой стороны, быть в непосредственной близости от перфторуглерода, а не в объеме водной фазы. Иными словами, ионы Gd3+ должны находиться в слое полимера, адсорбированного на поверхности капель эмульсии. Это учитывалось при создании двухмодального контрастного агента.
Материалы и методы
Получение контрастного агента.
В работе использовали водную эмульсию ПФТБА, стабилизированную полимером проксанолом-268, а также препарат Омнискан® фирмы Никомед (Австрия), содержащий 0,5 моль/л (287 мг/мл) гадодиамида: ([5,8-бис(карбокси-метил-11-[2-(метиламино)-2-оксоэтил]-3-оксо-2,5,8,11-тетраазатридекан-13-оата] гадолиния.
Для введения Gd-хелата в полимерную оболочку капель эмульсии сначала добавляли 15 мл Омнискана® к 105 мл водного раствора полимера проксанола-268, а затем приливали к нему при интенсивном перемешивании под давлением 30 мл ПФТБА. В результате этой процедуры в растворе формировались капли перфторуглерода, в оболочках которых был сосредоточен хелат гадолиния. Концентрация ПФТБА в полученной эмульсии составляла 20 об.%.
Определение размера частиц контрастного агента.
Размеры частиц эмульсии определяли методом динамического светорассеяния на установке ALV/DLS/SLS-5000, оборудованной гелий-неоновым лазером с длиной волны 632,8 нм. Образцы помещали в стеклянные кюветы радиусом 5 мм, погруженные в иммерсионную жидкость (толуол), имеющую показатель преломления, близкий к стеклу, чтобы избежать отражения луча на границе воздуха и кюветы. Кювету термостатировали водным циркуляционным термостатом. Перед измерениями образцы разбавляли в 10 раз.
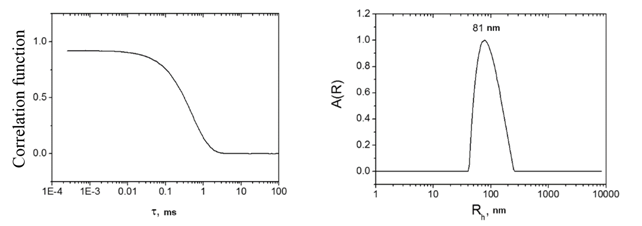
На рисунке 1 представлена корреляционная функция рассеянного света для образцов ПФТБА после добавления Омнискана® и распределение рассеивающих объектов по размерам, полученное обработкой этой функции методом CONTIN [9].
|
|
Рис. 1. Автокорреляционная функция
рассеянного света (слева) и распределение рассеивающих объектов
по
гидродинамическим радиусам (справа) для эмульсии ПФТБА - Омнискан®, угол
рассеяния 90 градусов.
Видно, что гидродинамический радиус капель составляет 80 нм, что близко к радиусу капель эмульсии, приготовленной без Омнискана®. Следует отметить, что у раствора самого хелатного Gd-комплекса (без эмульсии) интенсивность сигнала в 300-1000 раз меньше характерного сигнала от капли эмульсии. Таким образом, вкладом в рассеяние от хелатных комплексов, не связанных с каплями эмульсии, можно пренебречь.
Определение содержания гадолиния в контрастном агенте.
Для того чтобы определить, какая доля Gd-комплексов находится в связанном состоянии в адсорбционном слое на каплях эмульсии, а какая осталась в водном растворе, капли эмульсии отделяли центрифугированием и анализировали водную фазу. Центрифугирование проводили при 20000 G в течение 1 часа. Из верхнего прозрачного водного слоя центрифужной пробирки отбирали пробу для определения содержания гадолиния. Содержание гадолиния определяли при помощи рентгено-флуоресцентного анализа (РФА) на рентгеновском спектрометре VRA-30 (Карл-Цейс), оборудованном трубкой с анодом из молибдена (40Кв, 20 мА).
Согласно данным РФА, содержание Gd в водной фазе эмульсии составило 0,39 мг/мл, в то время как в исходной системе концентрация Gd была равна 7,85 мг/мл. Таким образом, более 95% Gd-хелата, введенного в ПФУ систему, оказалось сосредоточенным в адсорбционном слое частиц эмульсии.
ЯМР - измерения.
ЯМР-измерения проводили на 7 Тл магнитно-резонансном томографе BioSpec 70/30 USR фирмы Bruker. Для регистрации 19F-ЯМР-спектров (283 МГц) применялся модифицированный нами фирменный резонатор [10], изначально предназначенный для регистрации только протонных сигналов на частоте 300 МГц.
Результаты и обсуждение
19F-ЯМР-спектры, полученные для исходной немодифицированной эмульсии и для эмульсии с введенным Gd-хелатом, представлены на рисунке 2. Можно отметить, что различие 19F-ЯМР-спектров от исходных и модифицированных эмульсий мало – наблюдается небольшой сдвиг линий в сторону сильного поля, а также незначительное уширение основных пиков, что обусловливается взаимодействием ядер фтора с ионами Gd3+.
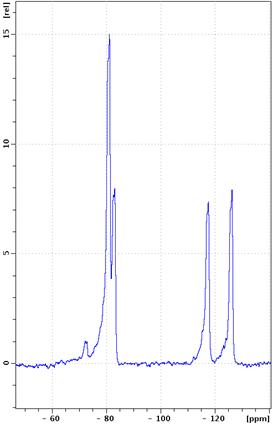
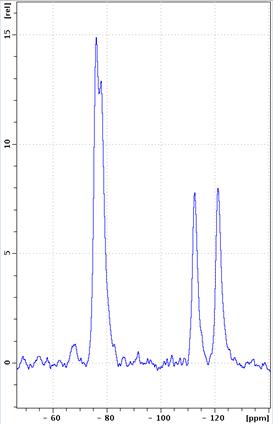
Рис. 2. - 19F-ЯМР-спектры
фторуглеродной эмульсии ПФТБА (а) – исходной, (б) модифицированной введением
хелата гадолиния из препарата Омнискан® (концентрация ПФТБА – 20 об.%,
концентрация гадолиния – 7,49 мг/мл).
Значения времени релаксации T1 образцов были измерены на МР-томографе методом насыщение-восстановление при варьировании параметра TR (использована фирменная программа RAREVTR). Было выявлено, что введение парамагнитных ионов в эмульсию заметно уменьшает время Т1 ядер водорода – практически в 40 раз: для исходной эмульсии ПФТБА Т11Н≈1805±30 мс, а для модифицированной эмульсии ПФТБА при 10-кратном разведении (до концентрации ионов гадолиния 0,749 мг/мл) Т11Н≈47±2 мс.
Интересно сравнить данное значение с T1 протонов «чистого» Омнискана® (без ПФТБА), содержащего такое же количество ионов гадолиния. Для этого «чистый» Омнискан® разбавляли в 100 раз. Получено, что для «чистого» Омнискана®, содержащего 0,749 мг/мл ионов гадолиния, Т11Н≈56±3 мс. Сравнивая полученные значения T1 для протонов, можно сделать вывод, что введение в организм модифицированной фторуглеродной эмульсии должно иметь такой же эффект на протонных МРТ-изображениях, как и введение фирменного контрастного агента Омнискан®.
Были также проведены измерения T1 для ядер фтора. Выявилось, что при добавлении Gd-хелатов в эмульсию это время практически не меняется. Так, для исходной эмульсии ПФТБА Т119F≈250±15 мс, для модифицированной эмульсии ПФТБА – Омнискан® Т119F≈230±10 мс. Этот результат согласуется с известными данными, согласно которым влияние Gd на T1 для ядер фтора максимально при магнитном поле 1,5 Тл, широко используемом в МРТ диагностике. При дальнейшем увеличении напряженности поля влияние Gd-хелатов на релаксацию ядер фтора снижается [11].
Выводы
Полученная нами модифицированная эмульсия ПФТБА путем внедрения Gd-хелатов в полимерную оболочку ее капель не только дает сильный 19F-ЯМР сигнал, но и существенно влияет на продольную релаксацию протонов. Поэтому данная эмульсия может быть использована в качестве двумодального контрастного МРТ агента. Для ее изготовления использован аптечный Gd-содержащий препарат Омнискан®, поэтому нет оснований полагать, что токсичность модифицированной эмульсии окажется выше, чем у исходной.
МРТ измерения проводились в ЦКП МГУ «Биоспектротомография» на томографе Bruker BioSpec 70/30 USR, входящем в состав уникального комплекса научных установок (УНУ) с тем же названием «Биоспектротомография».
Работа выполнена при поддержке грантом Минобрнауки РФ № 14.604.21.0060 (RFMEFI60414X0060).
Литература
1. Haacke E.M., Brown R.W., Thompson M.R., Venkatesan R. Magnetic Resonance Imaging: Physical Principles and Sequence Design / John Wiley & Sons, 1999, 914 p.
2. Toth E., Helm L., Merbach A.E. // Top. Curr. Chem. 2002. V. 221. P. 61.
3. Lin S.P., Brown J.J. // J. Magn. Reson. Imaging. 2007. V. 25. P. 884.
4. Caravan P., Ellison J.J., McMurry T.J., Lauffer R.B. // Chem. Rev. 1999. V. 99. P. 2293.
5. Faucher L., Tremblay M., Lagueux J., Gossuin Y., Fortin M.A. // ACS Appl. Mater. Interfaces. 2012. V. 4. P. 4506.
6. Mason R.P., Bansai N., Babcock E.E., Nunnally R.L., Antich P.P. // Magn. Reson. Imaging. 1990. V. 8. P. 729.
7. Ribeiro A. A., Umayahara K. // Magn. Reson. Chem. 2003. V. 41. P. 107.
8. Goh F., Gross J.D., Simpson N.E., Sambanis A. // J. Biotechnol. 2010. V. 150. P. 232.
9. Provencher S. W. // Macromol. Chem. 1979. V. 180. P. 201.
10. Гуляев М.В., Гервиц Л.Л., Устынюк Ю.А., Анисимов Н.В., Пирогов Ю.А., Хохлов А.Р. Получение изображений в магнитно-резонансной томографии на ядрах 19F с помощью препарата Перфторан // Журнал радиоэлектроники [электронный журнал]. 2013. № 8. URL: http://jre.cplire.ru/jre/aug13/8/text/pdf .
11. Neubauer A. M., Myerson J., Caruthers S. D., Hockett F. D., Winter P. M., Chen J., Gaffney P. J., Robertson J. D., Lanza G. M., Wickline S. A. // Magn. Reson. Med. 2008. V. 60. P. 1066.