УДК 615.47:615.012.6
СОВМЕСТНЫЙ АНАЛИЗ СИГНАЛОВ ЭЛЕКТРОЭНЦЕФАЛОГРАММ, ЭЛЕКТРОМИОГРАММ И МЕХАНИЧЕСКОГО ТРЕМОРА ПРИ БОЛЕЗНИ ПАРКИНСОНА В РАННЕЙ СТАДИИ
О. С. Сушкова 1, М. С. Королев 1, А.В. Габова 2, С. Н. Иллариошкин 3, А. В. Карабанов 3, К. Ю. Обухов 4, Ю. В. Обухов 1
1 Институт радиотехники и электроники РАН
2 Институт высшей нервной деятельности и нейрофизиологии РАН
3 Научный центр неврологии РАН
4 Московский физико-технический институт
Статья получена 20 мая 2014 г.
Аннотация. Одним из путей поиска признаков болезни Паркинсона является совместный анализ сигналов разной модальности – электроэнцефалограммы (ЭЭГ), электромиограммы (ЭМГ) и механического тремора (МТ), измеряемого с помощью акселерометров. Частотную синхронизацию ЭЭГ, ЭМГ и МТ можно оценивать по частотно - временному распределению экстремумов вейвлет спектрограмм ЭЭГ, МТ и огибающей амплитудно-модулированного высокочастотного ЭМГ.
Ключевые слова: болезнь Паркинсона, механический тремор, электроэнцефалограмма, электромиограмма, акселерометр, частотная синхронизация, вейвлет-спектрограмма, огибающая электромиограммы.
Abstract. One of the ways of search for signs of Parkinson's disease (PD) is a joint analysis of signals of different modalities. It is an electroencephalogram (EEG), electromyogram (EMG) and mechanical tremor (MT) measured using accelerometers. Frequency synchronization of EEG, EMG and MT can be estimated by the frequency - temporal distribution of the extremes of wavelet spectrograms of the EEG, the MT and the shape of amplitude-modulated high-frequency EMG.
Key words: Parkinson's disease, mechanical tremor, electroencephalogram, electromyogram, accelerometer, frequency synchronization, wavelet spectrogram, shape of the EMG.
Введение
Диагностика доклинической стадии болезни Паркинсона (БП), т.е. стадии, на которой болезнь уже развивается, а клинические признаки еще не обнаруживаются, является актуальной задачей современной медицины и нейрофизиологии. Эту стадию изучают экспериментально на животных, провоцируя развитие заболевания [1]. В клинике провоцировать БП, очевидно, невозможно, поэтому клинические признаки БП изучаются на самых ранних стадиях проявлений болезни с надеждой экстраполировать эти признаки на доклиническую стадию для выделения группы риска.
Правильная диагностика ранних клинических проявлений БП до сих пор является достаточно трудной задачей. Признаки самых ранних стадий этого заболевания весьма многочисленны [2], однако в большинстве случаев они лишь относительно специфичны, каждый из них может встречаться и при другой мозговой патологии. Наиболее информативным методом диагностики болезни Паркинсона считается позитрон - эмиссионная томография, однако это очень дорогой метод и он не может широко использоваться во врачебной практике для диагностики доклинической и начальной стадии. Электроэнцефалографические (ЭЭГ) исследования, также как и исследования электромиографии (ЭМГ) мышц и механического тремора проводятся недорогими приборами по сравнению с установками нейровизуализации и поэтому могут широко применяться для скрининга населения с целью диагностики ранних стадий и выделения групп риска на доклинической стадии БП.
Доступные и достаточно распространенные методы клинической ЭЭГ применяются при обследовании пациентов с БП уже в течение пяти десятилетий, но до последнего времени успехи в этой области были достаточно скромными. Уже в первых работах было отмечено, что для пациентов с БП характерно снижение частоты доминирующего ритма ЭЭГ [3, 4]. Утверждалось также, что по мере прогрессирования заболевания происходит дальнейшее изменение мощности и частоты ЭЭГ. Достаточно критическое отношение к данным, полученным при БП на основе традиционной клинической записи ЭЭГ, связано с тем, что электроэнцефалограмма отражает прежде всего электрические процессы, происходящие в коре головного мозга и может лишь косвенно свидетельствовать о тех патологических процессах и функциональных перестройках, которые происходят в сложных корково-подкорковых сетях при развитии БП.
В настоящее время появились новые подходы к анализу ЭЭГ, в частности, использующие различные варианты вейвлет преобразований при самых разных патологиях мозга [5-7]. Такой подход открывает новые возможности, потому что позволяет подробно исследовать ЭЭГ в ее динамике. В работе [8] вейвлет преобразование было применено для анализа ЭЭГ пациентов с болезнью Паркинсона в ранней стадии. Так же как в работах, выполненных с помощью спектрального анализа, было отмечено достоверное снижение частоты доминирующего диапазона ЭЭГ. Однако наиболее интересным результатом была обнаруженная в этой работе дезорганизация, нестабильность во времени вейвлет спектрограмм ЭЭГ, особенно ярко выраженная в доминирующем частотном диапазоне. Эти данные согласуются с хорошо известными литературными данными о том, что характерной чертой БП признается синдром дезинтеграции, проявляющийся на разных системных уровнях, прежде всего в моторных зонах коры головного мозга [9, 10].
В связи с такими представлениями об особенностях электрической активности мозга при БП была предпринята разработка новых методов анализа, позволяющих оценивать частотно-временную и пространственно-временную динамику сигналов. Вейвлет преобразование ЭЭГ начали использовать для анализа электрической активности мозга еще в девяностые годы [5, 11, 12]. Однако этот высоко информативный метод анализа до сих пор не получил достаточно широкого практического применения, по-видимому, вследствие того, что в нем вейвлет преобразования применяются лишь для визуализации частотно-временной динамики ЭЭГ.
В работах [13, 14] был проведен анализ тремора у пациентов с дрожательной формой болезни Паркинсона и у здоровых испытуемых.
В этой связи количественная оценка частотно-временных спектрограмм ЭЭГ, таких как межполушарная асимметрия, наличие тета ритма, степени дезорганизации и их связанность с механическим тремором может быть полезным инструментом для диагностики на ранних стадиях БП. Ниже будут представлены методы количественной оценки вейвлет спектрограмм, в первую очередь оценки межполушарной асимметрии, степени их дезорганизации, и результаты совместного анализа ЭЭГ и механического тремора.
Больные и методы исследования
Для совместных исследований ЭЭГ, ЭМГ и механического тремора использовался 41-канальный многофункциональный комплекс для проведения нейрофизиологических исследований Нейрон-спектр-5 фирмы Нейрософт. Полоса пропускания ЭЭГ сигналов была от 0,3 до 35 Гц, частота дискретизации составляла 500 Гц. Полоса пропускания ЭМГ сигналов составляла от 0,5 до 250 Гц, частота дискретизации - 500 Гц. Тремор измерялся пъезоэлектрическими акселерометрами, расположенными на тыльных сторонах ладоней. Частота дискретизации составляла 1378 Гц.
Проведен клинический и электрофизиологический анализ тремора у пациентов с эссенциальным тремором, дрожательной формой болезни Паркинсона и у здоровых испытуемых. Использована методика акселерометрии для оценки вариабельности частоты и амплитуды дрожания. Сравнение временных диаграмм и спектральных составляющих тремора позволило выявить ряд характерных особенностей, важных для понимания его патогенеза и проведения дифференциальной диагностики этих заболеваний.
Для исследования было отобрано 15 больных страдающих болезнью Паркинсона. Диагноз был поставлен с применением клинико-диагностических критериев болезни Паркинсона Банка Мозга Великобритания [15]. Возрастной интервал с 60 лет до 74 лет, гендерные различия - 8 женщин и 7 мужчин. Длительность заболевания: у 14 человек менее года, а 1 человек болен 1,5 года. Для определения стадии заболевания использована шкала Хен-Яра [16], у 14 больных выявлена I стадия, у 1 больного – II стадия. Все больные были правшами. По принятой классификации форм заболевания: у 15 больных смешанная (акинетико-ригидно-дрожательная) форма БП, больные с акинетико-ригидной и дрожательной формами - 0 человек. Начало заболевания с тремора и брадикинезии с левой руки - 8 человек, с правой руки - 7 человек. Для оценки двигательных нарушений была использована унифицированная рейтинговая шкала оценки болезни Паркинсонизма - шкала UPDRS [17]. По шкале UPDRS 5 человек набрали - 10 баллов, 7 человек -11 баллов, 3 человека - 12 баллов. На момент исследования противопаркинсоническую терапию не получали.
Анализ ЭЭГ с помощью вейвлет преобразования Морле
Известно, что характерной чертой болезни Паркинсона является синдром дезинтеграции, проявляющийся на разных системных уровнях (двигательные нарушения, вегетативная, нейрогуморальная дезинтеграция, эмоциональные и психические нарушения). Обнаруженные методом вейвлет анализа изменения частотно-временной структуры ЭЭГ свидетельствовали о том, что дезинтеграция может проявляться также в динамике электрической активности мозга. В работе [9] были анализированы данные в основном у пациентов на 2-3 стадии заболевания (по шкале Хен-Яра). Ниже будут приведены результаты вейвлет анализа ЭЭГ не леченых пациентов на 1-й стадии БП в сравнении с контрольной группой и группой пациентов на 2-й и 3-й стадиях.
Частотно-временная спектрограмма непрерывного вейвлет преобразования Морле задается формулой:
Sx(τ,f) = |W(τ,f)|2, (1)
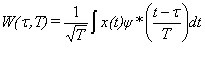 ,
(2)
,
(2)
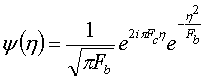 ,
(3)
,
(3)
где Sx (τ,f) - спектральная плотность мощности, f = 1/T, Fb, Fc - параметры, обычно принимают Fb = Fc = 1.
Вейвлет спектрограмма ЭЭГ состоит из серий пиков, отражающих изменения амплитуды спектральных коэффициентов в различных частотных диапазонах. Это не удивительно, учитывая, то, что ЭЭГ состоит из цугов колебаний различной частоты и длительности. На рис. 1 представлены вейвлет преобразования ЭЭГ здорового испытуемого (слева) и пациента с болезнью Паркинсона на 1 стадии по шкале Хен-Яра (справа).
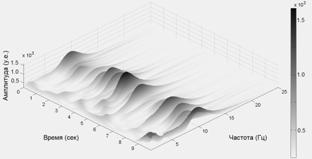
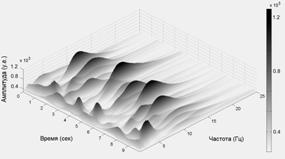
Рис. 1. Вейвлет спектрограммы ЭЭГ отведения С3. Слева - контроль, справа - пациент на 1-ой стадии БП.
Из рис. 1 видно, что как и у нормальных испытуемых, так и у пациентов с БП, вейвлет спектрограммы состоят из серии пологих пиков (примерно один - два раза в секунду) спектральной плотности мощности на частотно-временной плоскости. У нормальных испытуемых эти пики возникают на примерно одной частоте и образуют регулярные хребты, которые при Фурье анализе дают общепринятые ритмы – дельта, тета, альфа, бета и т.д. У пациентов с БП положение (координаты на частотно-временной плоскости) и разброс частот пиков существенно сильнее изменяется во времени и их спектральная мощность перераспределяется между частотными диапазонами. В частности, существенно возрастают пики в низкочастотном диапазоне (4 - 6 Гц). Корреляция частоты тремора и колебаний ЭЭГ в тета диапазоне была отмечена в ряде работ (обзор работ см., например, в [18]).
Доминирующий ритм ЭЭГ имеет амплитуду, превосходящую амплитуду других частотных диапазонов. Множество частот отдельных локальных максимумов отражает диапазон доминирующего ритма ЭЭГ. В норме все вершины пиков составляют четко выраженный хребет, представляющий собой альфа ритм, что говорит о достаточной стабильности частоты доминирующего ритма ЭЭГ у здорового человека. У пациентов на 1-ой стадии БП происходит значительная дезорганизация этой трехмерной картины: хребет вейвлет преобразования состоит из пиков, имеющих разную по сравнению с нормой частоту.
Идея работ [19, 20] заключается в том, что выделяя экстремумы пиков вейвлет спектрограмм и анализируя статистику распределения частотно-временных координат экстремумов и их мощности, можно обнаружить признаки БП в ранней стадии. Кроме того, эта статистика может быть разной у пациентов с различными стадиями заболевания. В качестве статистики используются гистограммы распределения по частоте количества экстремумов и/или их суммарной спектральной плотности мощности в некотором узком диапазоне частот.
Суть обработки и анализа вейвлет спектрограмм сигналов ЭЭГ заключается в том, что определяются амплитуды Ai(Fi, ti) пиков спектрограмм. Далее плоскость время-частота от (0-T, Fmin-Fmax) разбивается на окна с размерами (ΔT, ΔF). Размеры окна целесообразно выбирать по времени ΔT=(0,05-1,00) T сек, а по частоте – ΔF=(0,02-0,03) Fmax Гц. Затем в каждом окне вычисляются суммы амплитуд пиков спектрограмм ΣAi и строятся гистограммы распределения сумм ΣAi от частоты.
На рис. 2 приведены примеры распределений сумм амплитуд экстремумов в частотно-временных окнах. Вверху для волонтера из контрольной группы, внизу - для пациента на 1-й стадии БП. Слева - отведение С3, справа - симметричное отведение С4. Эти распределения показывают асимметрию электрической активности мозга в начальной стадии БП по сравнению с контролем, заключающуюся в дезорганизации доминирующего ритма, а именно, в увеличении частотного разброса его пиков в "больном" полушарии.
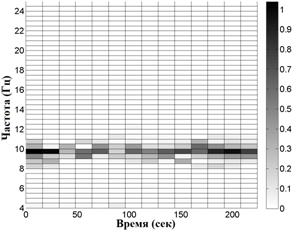
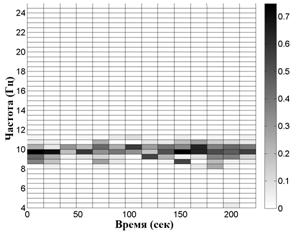
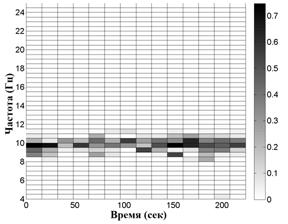
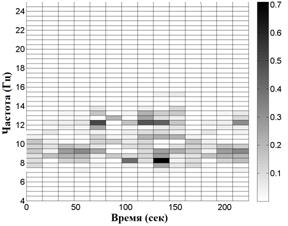
Рис. 2. Распределение сумм амплитуд
экстремумов вейвлет спектрограмм в
частотно-временных окнах.
Вверху для волонтера из контрольной группы, внизу -
для пациента на 1-й стадии БП с левосторонними проявлениями.
Слева - отведение
С3, справа - симметричное отведение С4.
Сигналы ЭЭГ по своей природе являются нестационарными, поэтому представляется целесообразным введение количественной оценки этой нестационарности (дезорганизации) и сопоставление ее в норме с ранними стадиями БП. Такая нестационарность соответствует представлениям о дезорганизации ритмов ЭЭГ при паркинсонизме. Суть предлагаемой оценки заключается в оценке по парных корреляций частотных распределений сумм амплитуд экстремумов по временным окнам [21].
Для примеров, представленных на рис. 2, число таких окон составляет 14. Соответственно, получается симметричная матрица коэффициентов корреляции с единичной диагональю. В норме корреляционные матрицы содержат значительное число больших коэффициентов корреляции, и, наоборот, у пациента с БП корреляционные матрицы содержат значительное число малых коэффициентов корреляции. Поэтому целесообразно для оценки степени дезорганизации (нестационарности) ритмов строить гистограммы коэффициентов корреляции в корреляционной матрице. На рис. 3 представлены гистограммы коэффициентов корреляции для отведений С3 и С4 тех же испытуемых. Видно, что в норме значения гистограмм коэффициентов корреляций сосредоточены в области больших значений, и, наоборот, у пациента эти значения разбросаны по всем значениям коэффициентов корреляции.
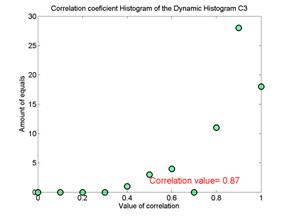
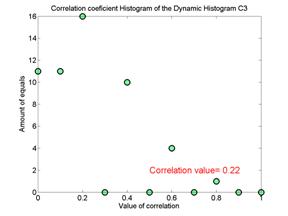
Рис.
3. Гистограммы коэффициентов корреляции
доминирующих ритмов в норме (слева) и пациента на 2-й стадии БП
(справа).
На
рисунках указана средняя арифметическая величина распределения
коэффициентов
корреляции.
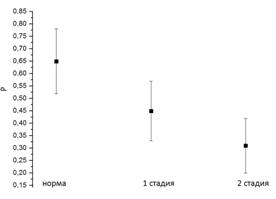
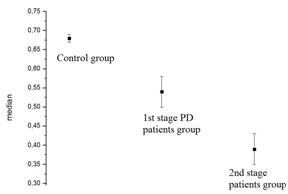
Рис.
4.
Средние арифметические (слева) и медианы коэффициентов корреляции для
отведений
С3 и С4
контрольной группы и отведений в "больном" полушарии групп
пациентов на 1-й и 2-й стадиях БП (справа).
При сравнении ЭЭГ симметричных участков правого и левого полушарий у обследованных пациентов постоянно обнаруживались существенные различия в распределении локальных максимумов вейвлет спектрограмм. Признаки дезорганизации ЭЭГ могли быть выражены сильнее либо справа, либо слева. Эти данные вполне соответствуют представлениям об асимметрии первых проявлений болезни Паркинсона [16].
В нейрофизиологии создан метод компьютерной регистрации и количественной оценки тремора, возникающего при неизменном поддержании позы суставного угла. Более детально этот метод описан ниже. Метод позволяет из широкого спектра электромиограммы выделить тот частотный диапазон сигнала, который создает двигательный акт. Основой метода является представление о том, что усилия мышц, действующие на сустав, создают движение, вид которого близок к кривой, огибающей ЭМГ [22].
Так как информация о треморе руки лежит не в самом сигнале ЭМГ, а в его огибающей, поэтому следует выделить отдельно огибающую ЭМГ. Огибающая ЭМГ вычисляется с помощью преобразования Гильберта [23].
Для выделения амплитуды и фазы произвольного сигнала u(t) (модулированный высокочастотный сигнал) необходимо создать на его основе аналитический сигнал (4):
![]() (4)
(4)
Вещественная часть аналитического сигнала совпадает с исходным сигналом u(t). Мнимая часть w(t) называется преобразованием Гильберта сигнала u(t). Вычисляется преобразование Гильберта следующим образом (5):
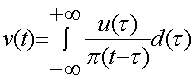 (5)
(5)
Подставляя (5) в формулу (4) и преобразуя формулу (4) в представленной форме (6), можно идентифицировать огибающую ЭМГ (7).
![]() ,
(6)
,
(6)
где a(t) – огибающая сигнала
![]() (7)
(7)
Оцифрованные записи ЭЭГ были обработаны фильтром Баттерворта 4-ого порядка для удаления частот 50 Гц, а также шума на 100 Гц.
На рис. 5 и 6 представлены частотно-временные распределения экстремумов вейвлет спектрограмм ЭЭГ в отведения С3, С4 моторной зоны коры головного мозга, а также экстремумы огибающей ЭМГ и тремора в контралатеральных конечностях.
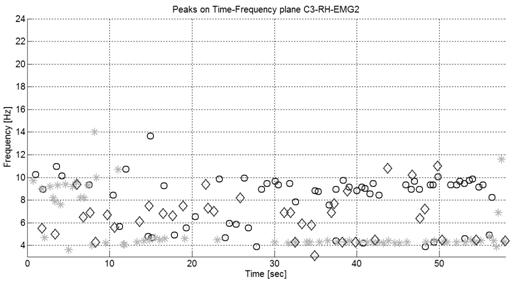
Рис. 5. Локальные максимумы на частотно-временном диапазоне отведений ЭЭГ в моторной зоне коры мозга C3 (кружочки) и контралатеральных МТ (звездочки) и ЭМГ (ромбики) больного на 1 стадии БП по качественной шкале Хен-Яра.
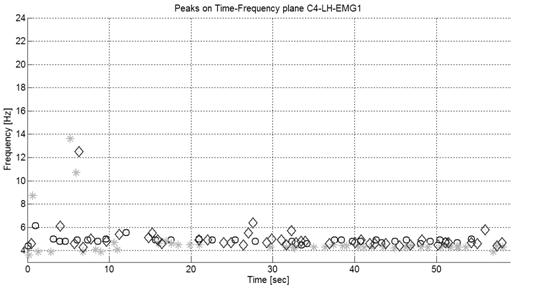
Рис. 6. Локальные максимумы на частотно-временном диапазоне межполушарно-симметричного отведения C4 и контралатеральных МТ и ЭМГ больного на 1 стадии БП по качественной шкале Хен-Яра.
Соответствующие интегральные гистограммы распределений частот локальных максимумов отображаются на рисунках 7, 8.
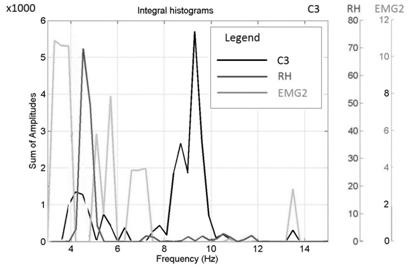
Рис. 7. Интегральные гистограммы частотных распределений локальных максимумов (клинически здоровое полушарие) с частотной рассинхронизацией в тета - диапазоне.
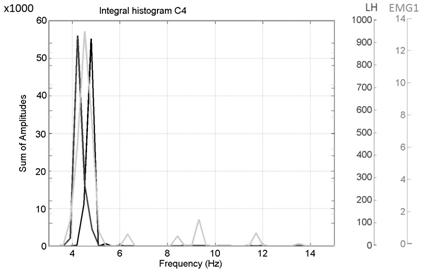
Рис. 8. Интегральные гистограммы частотных распределений локальных максимумов (больное полушарие) с частотной синхронизацией в тета - диапазоне.
На рис. 8, видно, что экстремумы в больной моторной зоне правого полушария частотно скоррелированы с экстремумами МТ и ЭМГ. Напротив, в еще клинически здоровом левом полушарии мозга такой корреляции нет (рис. 7).
С помощью разработанных методов и программ получены основные признаки БП в ранней стадии: межполушарная асимметрия частотно-временных характеристик ЭЭГ особенно в центральных отведениях (С3, С4); возникновение ритма в частотном диапазоне 4 - 6 Гц и его частотная синхронизация с электромиографической активностью и механическим тремором конечностей; дезорганизация доминирующего ритма ЭЭГ, соответствующая общим представлениям о дезорганизации различных систем при БП. Получены количественные оценки дезорганизации доминирующего ритма в центральных отведениях, которые позволяют различать группы практически здоровых людей от пациентов с БП на 1-й стадии и пациентов на 1-й стадии от пациентов на 2-й стадии.
Таким образом, с помощью вейвлет преобразования и его дальнейшего количественного анализа в работе был подтвержден ряд фактов, характеризующих особенности ЭЭГ на 2-3 стадиях болезни Паркинсона, и обнаружен ряд специфических особенностей частотно-временной организации ЭЭГ 1-й стадии заболевания.
Предложенные в данной работе подходы и разработки оказались адекватными для исследования различных этапов развития БП, в том числе ранних. Гистограммы экстремумов вейвлет преобразований ЭЭГ более четко по сравнению со спектрами Фурье подчеркивают признаки БП и позволяют изучать их динамику. Полученные данные намечают дальнейшие пути поиска специфических ЭЭГ маркеров самых ранних, в том числе доклинических, стадий заболевания.
Литература
1. М.В. Угрюмов. Традиционные представления о нейродегенеративных заболеваниях. - в книге Нейродегенеративные заболевания: фундаментальные и прикладные аспекты / под. ред. М.В. Угрюмова – М.: Наука, 2010. – IISBN 978-5-02-036710-4, стр. 8-51
2. K. Brockmann, D. Berg. Diagnosis of Parkinson's Disease. Parkinson Disease and Other Movement Disorders (eds. e. Wolters. C. Baumann). - Int. Ass. of Parkinsonism and Related Disorders, VU University Press, 2014, pp. 229-242
3. Ganglberger JA. The EEG in parkinsonism and its alteration by stereotaxically produced lesions in pallidum // EEG Clin. Neurophysiol. 1961. Vol. 13. P. 82.
4. Soikkeli, R., Partenen J., Soininen H. et al. Slowing of EEG in Parkinson’s disease // EEG Clin. Neurophysiol. 1991. V. 79. P. 159-165.
5. Pezard L, Jech R, Ruzicka E. Investigation of non-linear properties of multichannel EEG in the early stages of Parkinson’s disease // Clin. Neuriphysiol. 2001. Vol. 112. P. 38-45.
6. d’Atellis C.E., Isaacson S.I., Sime R.O. Detection of epileptic events in electroencephalograms using wavelet analysis // Ann. Biomed. Eng. 1997. Vol. 25. P. 286-293.
7. Габова А.В., Боснякова Д.Ю., Босняков М.С. и др. Частотно-временная структура разрядов пик-волна генетической absence-эпилепсии // Доклады РАН. 2004. Т. 396. С. 557-560.
8. Bosnyakova D.Yu., Obukhov Yu.V. Extraction of dominant feature in biomedical signals // Pattern Recogn. Image Anal. 2005. Vol. 15, P. 513-515.
9. Обухов Ю.В., Анциперов А.В., Гехт А.Б., Попов Г.Р., Габова, А.В., Жарикова А.В., Г.Д. Кузнецова. Частотно-временной анализ электрической активности мозга при болезни Паркинсона. В «Нейродегенеративные заболевания. Теория и практика», под ред. М.В.Угрюмова // М. Наука, 2010 стр. 112-129
10. Вейн А.М., Голубев В.Л., Яхно Н.Н. Паркинсонизм с позиций функционально-неврологического анализа // "Паркинсонизм: вопросы клиники, патогенеза и лечения". M., 1974. C. 57-65.
11. Голубев В.Л., Левин Я. И., Вейн А.М. Болезнь Паркинсона и синдром паркинсонизма // М.: МЕДпресс, 1999. 415 с.
12. Senhadji L., Wendling F. Epileptic transient detection wavelet and time-frequency approaches // Neurophysiol. Clin. 2002. Vol. 32. P. 175-92.
13. Голубев В.Л., Магомедова Р.К. Спектральный анализ вариабельности частотно-амплитудных характеристик дрожания при эссенциальном треморе и дрожательной форме болезни Паркинсона // Журнал неврологии и психиатрии им. С.С.Корсакова. 2006. Т.106, № 1. С.43–48.
14. Goetz C.G., Stebbins G.T., Wolff D. et al. Testing Objective Measures of Motor Impairment in Early Parkinson’s Disease: Feasibility Study of an At-Home Testing Device // Movement Disorders. 2009. Vol.24, № 4. P.551–556.Siff S.J., Aldroubi A., Unser M. et al. Fast wavelet transformation of the EEG // EEG Clin. Neurophysiol. 1994. Vol. 91. P. 442-445.
15. Gibb W. R., Lees A. J. The relevance of the Lewy body to the pathogenesis of idiopathic Parkinson's disease. J Neurol Neurosurg Psychiatry 1988;51:745-752
16. Hoehn M., Yahr M. Parkinsonism: onset, progression, and mortality. - Neurology 1967;17;427-442.
17. Fahn S., Elton R. Unified Parkinson's Disease Rating Scale. In: S. Fahn, C. Marsden, M. Goldstein, D. Calne, editors. Recent developments in Parkinson's disease. Florham Park (NJ): Macmillan Healthcare Information 1987; 153-163.
18. A. Oswal, V. Litvak, P. Brown. Syncronized Neural Oscillations and the Parkinsonian State. - Parkinson Disease and Other Movement Disorders (eds. e. Wolters. C. Baumann). - Int. Ass. of Parkinsonism and Related Disorders, VU University Press, 2014, pp. 163-181
19. Обухов Ю.В., Королев М.С., Габова А.В., Кузнецова Г.Д., Угрюмов М. В. Способ ранней электроэнцефалографической диагностики болезни Паркинсона – патент РФ, - 2484766, 20.06.2013
20. Королев М.С., Обухов Ю.В. Поиск признаков раннего паркинсонизма в электроэнцефалограммах // Нелинейный мир, 2012, № 2, стр. 131-132.
21. Обухов Ю.В., Королев М.С., Обухов К.Ю. О количественной оценке нестационарности ритмов электроэнцефалограмм в норме и при паркинсонизме в ранних стадиях. Математические методы распознавания образов ММРО-10, Казань, 6-12 октября 2013 г., Тезисы докладов 16 Всероссийской конференции, Тезаурус Пресс, Москва, 2013, стр. 79
22. Андреева Е.А., Хуторская О.Е. Спектральный метод анализа электромиографической активности мышц //- М. Наука, 1987 - 192с
23. Д.Е. Вакман, Л. А. Вайнштейн. Амплитуда, фаза, частота – основные понятия теории колебаний. // Успехи физических наук. – 2000. - Том. 123, Номер. 4, - С. 657-682.