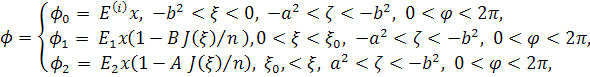ДИСТАНЦИОННАЯ АКТИВАЦИЯ С ПОМОЩЬЮ ИМПУЛЬСНОГО ЭЛЕКТРИЧЕСКОГО ПОЛЯ НАНОКОМПОЗИТНЫХ МИКРОКАПСУЛ НА ОСНОВЕ КОМПЛЕКСОВ ЛИПИДОВ, ПОЛИМЕРОВ И ПРОВОДЯЩИХ НАНОЧАСТИЦ
Ю. В. Гуляев1, В. А. Черепенин1,
В. А. Вдовин1, И. В. Таранов1, В. В. Файкин1,
В. И. Тюкавин1,
В. П. Ким2, Ю. А. Кокшаров2, П.
А. Кормакова2, К. В. Потапенков2,
А. А. Рахнянская3, А. В. Сыбачин3, Е. Г. Ярославова3,
А. А. Ярославов3, Г. Б. Хомутов1, 2
1 Институт радиотехники и электроники им. В.А.Котельникова РАН
2 Физический факультет МГУ им. М.В. Ломоносова
3 Химический
факультет МГУ им. М.В. Ломоносова
Статья получена 10 ноября 2014 г.
Аннотация. В данной статье представлены результаты работ по созданию новых чувствительных к внешнему нетепловому электрическому воздействию нанокомпозитных гибридных систем для инкапсулирования, адресной доставки и контролируемого высвобождения доставляемых веществ в водных средах на основе липидов, новых функциональных амфифильных молекул, полимеров и проводящих наночастиц. Основу таких систем составляют липосомы, содержащие электронейтральные биогенные липиды и специальные синтетические амфифильные молекулы, обеспечивающие связывание с липосомами полимеров и функциональных неорганических наночастиц. В данной работе использовались катионные липосомы на основе фосфатидилходина, содержащие до 20% катионного амфифильного соединения стеарилспермина; в качестве неорганических наночастиц использовались проводящие наночастицы магнетита Fe3O4; в качестве полимеров использовались полианионы – молекулы полистиролсульфоната. Нанокомпозитные липосомы формировали путем последовательной адсорбции на предварительно полученные ультразвуковым методом катионные липосомы коллоидных наночастиц магнетита и слоя полианиона. Полученные структуры исследовали методами просвечивающей электронной микроскопии, атомно-силовой микроскопии, электронного магнитного резонанса, лазерного светорассеяния, электрофореза, кондуктометрии и др. Для дополнительного контроля эффекта декапсуляции, возникающего вследствие нетеплового импульсного электрического воздействия на полученные нанокомпозитные липосомы, в их внутренний объем был помещенали раствор NaCl. В данной работе приведены результаты проведённого исследования возможности дистанционной активации нанокомпозитных липосом путем воздействия коротких (порядка 1 нс) электрических импульсов высокой напряженности (порядка сотни кВ/м). Предложена модель, описывающая механизм взаимодействия наноструктурированных липосом, содержащих на поверхности проводящие наночастицы, с внешним электрическим полем, которое приводит к существенному изменению структуры липосомы. Получены оценки критических значений внешнего электрического поля, приводящего к декапсуляции нанокомпозитных липосом. Полученные результаты указывают на возможность создания нанокомпозитных гибридных липосом и везикул на основе комплексов липидов, полимеров и наночастиц, структура и проницаемость оболочек которых может изменяться контролируемым образом с помощью нетеплового импульсного электрического воздействия. Такие наносистемы могут являться основой для создания новых эффективных средств инкапсулирования, адресной доставки и управляемого высвобождения различных веществ в водных средах, перспективных для био-медицинских и других применений.
Ключевые слова: капсулы, липосомы, структура, наночастицы, магнетит Fe3O4, полиэлектролиты, импульс электрического поля.
Abstract. In the paper we present results on the design, preparation and characterization of novel nanocomposite hybrid systems sensitive to external non-thermal electric field pulses and perspective for capsulation, targeted transport, controlled spatial localization and stimuli-addressed delivery of various compounds in aqueous media. The systems were formed from lipids, new functional amphiphilic molecules, polymers and conducting nanoparticles and were based on cationic liposomes containing electroneutral biogenic lipids and specific synthetic amphiphilic polyamine molecules which provide the binding of polyanions and functional inorganic nanoparticles with liposomes. In the present work cationic liposomes were formed from phosphatidylcholine and contained up to 20% of cationic amphiphilic compound stearylspermine. Magnetite Fe3O4 nanoparticles were used as magnetic conducting inorganic nanoparticles, polystyrene sulfonate was used as a polyanion. Nanocomposite capsules were prepared by sequential adsorption of colloid inorganic nanoparticles and polyanions onto the cationic hybrid liposomes presynthesized using conventional ultrasound technique. The fabricated nanostructures have been studied using a number of techniques including transmission electron microscopy, atomic force microscopy, electron mafnetic resonance, laser light scattering, electrophoresis, conductometry, etc. With the aim of additional control of decapsulation resulting from the non-thermal electric pulse effect on the prepared nanocomposite liposomes the NaCl solution was placed in the liposomal internal volume. In the present work we describe the results of the study of possibilities for remote activation of nanocomposite liposomes via action of short high voltage electric pulses (duration ~ 1 ns, electric field strength about hundreds kV/m). The model describing the mechanism of interaction of nanostructured liposomes containing the conducting nanoparticles on their surface with external electric field resulting in substantial changes of liposome structure is proposed. The evaluations of external electric field critical values resulting in nanocomposite liposomes decapsulation have been carried out. The data obtained point to the possibilities for creation of nanocomposite hybrid liposomes and vesicules on the base of complexes of lipids, polymers and nanoparticles which are characterized in that their shell structure and permeability can be changed controllably by effect of non-thermal electric pulses. Such nanosystems can be a base for creation of novel efficient tools for capsulation, targeted transport and controlled delivery of various compounds in aqueous phases prospective for bio-medical and other applications.
Keywords: capsules, liposomes, structure, nanoparticles, magnetite Fe3O4, polyelectrolytes, pulse electric field.
1. Введение
В настоящее время важной проблемой, обусловливающей дальнейший прогресс в медицине, фармакологии, косметологии, сельском хозяйстве, биотехнологиях и в ряде других областей, является проблема создания эффективных систем для инкапсулирования и адресной доставки лекарств и других биологически-активных веществ в определенное заданное место организма, обеспечивающих управляемое постепенное или единовременное высвобождение доставляемых соединений в заданном месте и в нужное время. Разработка таких систем требует решения сложного комплекса взаимосвязанных биологических, химических, физических и нанотехнологических задач, и привлекает всё больший интерес исследователей в ведущих странах мира. Основными вопросами, которые необходимо решить в рамках этой проблемы, являются следующие: как инкапсулировать и «адресно» доставить лекарственный препарат в определенное место (или места) организма на носителе и как обеспечить его контролируемое высвобождение от носителя. При этом также необходимо учитывать потенциальную токсичность используемых веществ и материалов с целью максимального уменьшения возможных побочных негативных воздействий на организм. В настоящее время разрабатываются и тестируются наноконтейнеры на основе полимеров, в том числе дендримеров, мицелл, липосом, фуллеренов, гидрогелей и т.п., а также исследуются возможности их активации и управляемого высвобождения инкапсулированных веществ [1-6].
В последнее время благодаря методу послойной полиионной сборки появился новый класс интересных микрообъектов – полиэлектролитные и нанокомпозитные полые микрокапсулы [7-9]. Микрокапсулы обладают рядом уникальных свойств (например, стенки микрокапсул могут изменять свою проницаемость при изменении химических параметров их локального окружения или под действием внешних физических воздействий), благодаря которым они в будущем могут найти широкое применение в медицине, биологии, химии и технологии. Установлена возможность управления проницаемостью оболочки микрокапсул посредством изменения величины рН раствора [10], действием лазерного излучения [11, 12], переменного магнитного поля [13] и воздействия СВЧ-излучения [14, 15]. Дистанционно управляемая целенаправленная адресная доставка лекарственных веществ с помощью нанокомпозитных полимерных микрокапсул, чувствительных к импульсному электромагнитному воздействию, позволит существенно повысить эффективность действия лекарственных препаратов, уменьшая при этом их общую концентрацию в организме, что особенно важно для специфических лекарств, обладающих выраженной токсичностью (например, медикаментов, применяемых в области лечения онкологических заболеваний).
Наряду с вышеописанными свойствами и перспективными применениями для инкапсулирования лекарственных соединений полиэлектролитные микрокапсулы обладают определенными недостатками, связанными с многостадийной и довольно трудоемкой процедурой их получения, затрудняющей создание технологий их массового производства. Также, существенные трудности связаны с капсулированием многих веществ, поскольку полиэлектролитная оболочка таких капсул имеет высокую проницаемость для низкомолекулярных соединений. Вышеуказанных недостатков лишены липидные биомиметические везикулы - липосомы, широко используемые в модельных биофизических исследованиях и весьма перспективные для биомедицинских применений [16, 17]. Важной отличительной чертой использования липосом в качестве основы для создания систем капсулирования и адресной доставки лекарств и других соединений является их биосовместимость, поскольку мембрану липосом обычно формируют из фосфолипидов (биогенные амфифильные молекулы, входящие в состав биологических мембран). Круг веществ, которые могут быть завключены в липосомы, чрезвычайно широк – от неорганических ионов и низкомолекулярных органических соединений до крупных белков и нуклеиновых кислот. Водорастворимые (гидрофильные) лекарственные вещества могут быть заключены во внутреннее водное пространство липосом, а жирорастворимые (гидрофобные) – в бислойную липидную мембрану. Однако, традиционно получаемые фосфолипидные липосомы, как правило, характеризуются низкой стабильностью и относительно коротким временем жизни, что ограничивает возможности их практического применения и требует разработки новых эффективных функциональных липосомальных систем [18].
Новые подходы в создании липосомальных препаратов включают конструирование липосом, способных к управляемому выходу инкапсулированных веществ: такие липосомы могут подвергаться структурным изменениям в ответ на физико-химические стимулы. Примерами таких липосом являются термочувствительные липосомы, из которых при гипертермии происходит выход инкапсулированного лекарства, и рН-чуствительные липосомы, раскрытие которых происходит в кислой среде [19, 20].
Перспективным подходом к решению задачи управления пространственной локализацией микроконтейнеров с лекарственными соединениями и их адресной доставки в организме является включение в их состав магнитных наночастиц, что открывает возможности дистанционного управления ими при помощи внешнего магнитного поля. Идея целевой доставки терапевтических средств (таких как олигонуклеотиды, белки, лекарственные препараты) с использованием магнитного поля была предложена Виддер в 1978 г. [21]. В настоящее время наиболее широкое применение в биомедицине получили наночастицы магнитных оксидов железа (в основном, магнетита Fe3O4), что обусловлено их низкой токсичностью, довольно высокой намагниченностью насыщения и стабильностью магнитных характеристик [22-29]. Биомедицинские применения магнитных наночастиц в основном связаны с диагностикой (биосенсоры, контрастные средства для магнито-резонансной томографии, маркеры биомолекул, биосепарация и пробоподготовка, исследования молекулярного взаимодействия) и адресным терапевтическим воздействием (целевая доставка терапевтических молекул, в том числе ДНК, управляемая локальная гипертермия опухолей и др.) [23, 30, 31]. Нами разрабатываются новые перспективные системы для инкапсулирования, адресной доставки и управляемого высвобождения различных веществ в водных средах, чувствительных к внешнему нетепловому электромагнитному воздействию. Основу таких систем составляют нанокомпозитные коллоидные везикулы и капсулы, представляющие собой гибридные конструкции, включающие липиды, поверхностно-активные соединения, полимеры (в том числе биополимеры), неорганические наночастицы и другие функциональные компоненты.
В данной статье представлены результаты работ по созданию нанокомпозитных микрокапсул, чувствительных к внешнему нетепловому электрическому воздействию, построенных на основе биогенных липидов, новых синтетических функциональных катионных амфифильных молекул, полимеров и наночастиц магнетита.
Предложен механизм, описывающий взаимодействие наноструктурированных липосом, содержащих на поверхности проводящие наночастицы, с внешним нетепловым электрическим полем, который приводит к существенному изменению структуры липосомы. Получены оценки критических значений внешнего, электрического поля, приводящего к декапсуляции нанокомпозитных липосом.
2. Материалы и методы
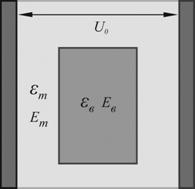
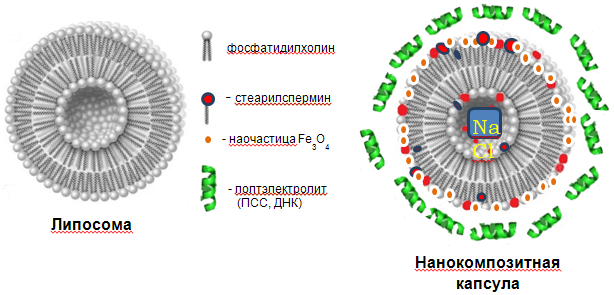
В данной работе нами были синтезированы нанокомпозитные липосомальные системы, схема строения которых представлена на Рис. 1.
|
Рисунок 1. Схема строения обычной бислойной фосфолипидной липосомы (слева) и синтезированных в данной работе нанокомпозитных липосомальных микрокапсул на основе биогенных фосфолипидов, новых синтетических функциональных катионных амфифильных молекул стеарилспермина, полиэлектролитов и магнитных наночастиц магнетита. |
В работе использовали соли FeCl3, FeCl2, спермин, стеариновую кислоту, фосфатидилхолин фирм Sigma/Aldrich и Fluka.
Синтез коллоидных наночастиц магнетита Fe3O4 проводился с помощью известного метода, описанного Массартом [32] с использованием в качестве прекурсоров солей двухвалентного и трехвалентного железа в ходе химической реакции, описываемой общим уравнением:
2FeCl3 + FeCl2 + 8NH4OH = Fe3O4 + 8NH4Cl + 4H2O
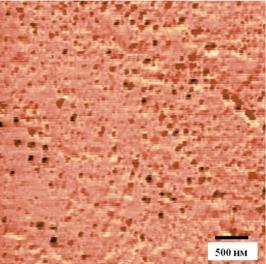
Соли двухвалентного и трехвалентного железа смешивались в соотношении: 10 мл 1M FeCl3 к 2,5 мл 2M FeCl2. Получившийся раствор вливался в 125 мл 0,7 NH4OH и интенсивно перемешивался в течение 30 мин. Далее полученные наночастицы магнетита осаждались магнитным полем постоянного магнита и электростатически стабилизировались водным раствором соляной кислоты (рН=3,7). Далее стабилизированные коллоидные наночастицы магнетита обрабатывались ультразвуком в течение 15 мин, в результате получался стабильный коллоидный раствор наночастиц магнетита. В полученных стабильных коллоидных растворах наночастиц магнетита стабилизация обеспечивалась межчастичным электростатическим отталкиванием наночастиц в отсутствие каких-либо стабилизирующих лигандов. Средний размер наночастиц магнетита в образцах по данным просвечивающей электронной микроскопии (ПЭМ) составлял 6-8 нм (Рис. 2).
Для синтеза липосом использовались растворы фосфотидилхолина и стеарилспермина в хлороформе. Стеарилспермин – амфифильное соединение, образованное путем связывания стеариновой кислоты и биогенного полиамина спермина амидной связью. Синтез липосом из молекул стеарилспермина и фосфатидилхолина проводился путем смешивания исходных веществ в хлороформе, количество молекул стеарилспермина составляло 20-25% от общего числа молекул липосомальной мембраны. Затем раствор высушивали с использованием роторного испарителя, после чего на стенке испарительной колбы образовывалась пленка липида и стеарилспермина. Далее добавление к сухой пленке водного раствора (рН=4.5) приводило к образованию многослойных липосом. После этого полученная суспензия обрабатывалась в течение 10 мин ультразвуком. Ультразвуковое воздействие необходимо для получения однослойных липосом с меньшими размерами и узкой дисперснотью.
Адсорбция наночастиц магнетита на липосомы проводилось путем добавления 40 мкл полученного раствора наночастиц магнетита и 100 мкл раствора липосом в 800 мкл деионизованной воды c рН=4,5 (доведенной соляной кислотой). Прочное связывание катионных наночастиц магнетита с липосомами, содержащими стеарилспермин, обусловлено, по видимому, образованием координационных связей между ионами железа наночастиц магнетита и аминогруппами спермина. Эффект образования высокоорганизованных поликомплексов наночастиц магнетита и спермина в объемной водной фазе описан ранее в литературе [33]. Аналогичным образом проводилась адсорбция на липосомы молекул полиэлектролита (полистиролсульфонат). Получение липосомальных систем, содержащих во внутреннем пространстве везикулы концентрированный раствор NaCl, получали стандартным методом с использованием процедуры диализа.
Для получения электронно микроскопических изображений образцов в работе использовали просвечивающий электронный микроскоп LEO 912AB, фирмы IOMEGA (Германия). Образцы для измерений методом просвечивающей электронной микроскопии (ПЭМ) получали путем нанесения микрокапель водной суспензии, содержащей исследуемые объекты, на поверхность специальных подложек, выполненных в виде медных сеток (диаметр 3 мм), покрытых ультратонким слоем полимера (формвар) и аморфного углерода.
Методами динамического светорассеяния и электрофореза на установке Brookhaven instruments corporation 90 Plus проводились измерения размеров коллоидных частиц и ζ-потенциала в суспензиях наночастиц магнетита и липосом.
Образцы для измерений методом сканирующей атомно-силовой микроскопии (АСМ) были приготовлены путем адсорбции липосом и микрокапсул на атомарно-гладкую подложку – свежие сколы слюды. Затем образцы промывались в чистой воде и высушивались. Измерения проводились с использованием сканирующего зондового атомно-силового микроскопа Solver фирмы NTMDT (Россия).
Дистанционную активацию нанокомпозитных липосом проводили путем воздействия на водную суспензию липосом короткими (длительностью порядка 1 нс) электрическими импульсами высокой напряженности. Пластиковые полипропиленовые кюветы объёмом 0,5 мл с суспензией липосом помещались в зазор между плоскими электродами. Зазор между электродами составлял 1 см и во избежание пробоя заполнялся маслом, подаваемое напряжение на обкладки составляло 150 кВ, проводилась серия из 7 коротких импульсов длительностью 1 нс.
3. Результаты и обсуждение
На Рис. 2 представлено электронномикроскопическое изображение синтезированных наночастиц. Средний диаметр наночастиц составил 6-8 нм.

Рисунок 2.
Характерное электронно-микроскопическое изображение
коллоидных наночастиц
магнетита Fe3O4.
Изображение получено
методом просвечивающей электронной микроскопии.
С целью установления структуры синтезированных наночастиц с помощью метода ПЭМ были получены картины электронной дифракции на наночастицах, характерное изображение такой электронограммы представлено на Рис. 3. При сравнении экспериментальной дифрактограммы с дифрактограммой эталонного образца наночастиц магнетита наблюдалось совпадение положения дифракционных рефлексов и их интенсивностей, что свидетельствует о том, что полученные наночастицы представялют собой нанофазный магнетит. Ввиду того, что характеристики кристаллической решетки другого магнитного оксида железа – маггемита Fe2O3 - очень близки параметрам решетки магнетита, не исключено присутствие в образце примесей магнитной нано-фазы маггемита.
![Image5 [1]](text.files/image003.jpg)
![diffraction_Image16 [1]2](text.files/image004.png)
Рисунок 3. Дифрактограммы
электронов в образце стандартных коллоидных наночастиц магнетита (слева)
и
синтезированных в работе наночастиц (справа). Цифрами указаны номера
кристаллографических плоскостей
кристаллической фазы магнетита, обусловливающих
соответствующие рефлексы.
Был определен электростатический поверхностный ζ-потенциал полученных коллоидных наночастиц магнетита, который составлял 15,5 мВ±0,8мВ.
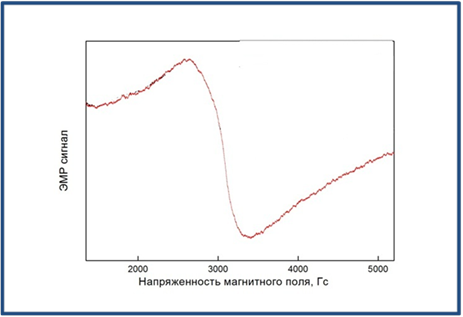
Рисунок 4. Спектр ЭПР синтезированных наночастиц магнетита.
Магнитные свойства синтезированных наночастиц исследовались с помощью метода ЭПР. Спектр ЭПР суспензии синтезированных коллоидных наночастиц магнетита представлен на Рис. 4 и представляет собой широкий сигнал, характерный для образцов ферромагнитных и суперпарамагнитных наночастиц магнетита [23].
Синтезированные липосомы на основе фосфатидилхолина и стеарилспермина исследовались методами динамического светорассеяния на установке Brookhaven instruments corporation 90 Plus. Диаметр синтезированных липосом по данным светорассеяния составлял не более 200 нм, а величина ζ-потенциала была около 8 мВ. Положительная величина поверхностного потенциала липосом объясняется наличием катионных аминогрупп стеарилспермина на поверхности липосомальной мембраны. На Рис. 5 представлено топографическое изображение таких липосом на поверхности слюды, полученное методом АСМ. Как видно из Рис. 5, размеры липосом, определенные методом динамического светорассеяния и с помощью атомно-силовой микроскопии, довольно хорошо совпадают.
|
|
|
|
|
Рисунок 5. Топографическое изображение липосом на поверхности слюды, полученное методом АСМ. Липосомы состоят из фосфатидилхолина и стеарилспермина.
|
|
Рисунок 6. Топографическое изображение липосом с адсорбированными наночастицами магнетита, полученное методом АСМ. |
На Рис. 6 представлено топографическое изображение липосом с адсорбированными наночастицами магнетита. Как видно из рисунка, связывание наночастиц магнетита с липосомами не приводит к заметным изменениям их морфологии.
Полученные нанокомпозитные везикулы также исследовались методами ПЭМ и динамического светорассеяния. ζ-потенциал липосом с адсорбированными наночастицами магнетита составил 20,5±0,5 мВ. Возрастание величины поверхностного электростатического потенциала обусловлено связыванием с поверхностью катионных наночастиц магнетита. На Рис. 7 представлены характерные электронномикроскопические изображения нанокомпозитных липосом с адсорбированными наночастицами магнетита. Из рисунка 7 видно, что связанные наночастицы магнетита довольно однородно распределены по поверхности липосом, при этом липосомы имеют квази-сферическую форму и размеры около 200 нм, что совпадает с вышеприведенными результатами измерений методами динамического светорассеяния и АСМ.
|
|
|
|
Рисунок 7. Электронномикроскопические изображения липосом с адсорбированными наночастицами магнетита. Справа - увеличенное изображение нанокомпозитной липосомы. Изображения получены методом ПЭМ. |
|

Рисунок 8. Электронномикроскопическое изображение нанокомпозитных липосом,
состоящих из
молекул фосфатидилхолина и стеарилспермина с адсорбированными наночастицами
магнетита,
содержащих во внутреннем объеме соль NaCl.
Изображение получено методом ПЭМ.
Было проведено исследование возможности загрузки нанокомпозитных липосом, образованных молекулами фосфатидилхолина и стеарилспермина с адсорбированными наночастицами магнетита, модельным низкомолекулярным соединением - раствором NaCl. С этой целью формирование липосом проводили в концентрированном водном растворе соли NaCl с последующим диализом и удалением ионов Na+ и Cl- из объема суспензии. На Рис. 8 представлено характерное электронномикроскопическое изображение полученных липосом, содержащих инкапсулированные кристаллы NaCl. На изображении отчетливо видны кристаллы соли NaCl, окруженные липидной липосомальной мембраной, при этом форма таких липосом искажена и отличается от сферической вследствие образования кристаллов соли во внутрилипосомальном пространстве.
Целостность липосомальной мембраны и эффективность капсулирования оценивали путем измерения проводимости суспензии липосом. Проводимость контрольной суспензии липосом (без соли NaCl) составляла 16,5 µS/cm, проводимость суспензии липосом, инкапсулированных раствором соли NaCl, была 16,7 µS/cm. Разрушение липосомальной мембраны и выход в наружную водную фазу раствора соли NaCl инициировали добавлением детергента Тритон X100. После добавления детергента проводимость суспензии в разных экспериментах возрастала до 100 µS/cm и более, что свидетельствует об эффективности капсулирования водорастворимых веществ синтезированными липосомами.
В настоящей работе
было проведено исследование возможности дистанционной активации нанокомпозитных
липосом путем воздействия коротких электромагнитных импульсов высокой
напряженности. Воздействие импульсного электрического
поля на водную суспензию наноструктурированных липосомальных микрокапсул
осуществлялось следующим образом (Рис. 10.а.). Между плоскими
электродами располагалось трансформаторное масло с относительной
диэлектрической проницаемостью ![]() . В пространство между электродами
помещался цилиндрический контейнер объёмом
0,5 мл, в котором находилась водная суспензия наноструктурированных
липосом
с характерными размером около
. В пространство между электродами
помещался цилиндрический контейнер объёмом
0,5 мл, в котором находилась водная суспензия наноструктурированных
липосом
с характерными размером около ![]() , в оболочки мембран которых были
иммобилизованы наночастицы магнетита c
характерным размером
, в оболочки мембран которых были
иммобилизованы наночастицы магнетита c
характерным размером ![]() , а внутренний объем липосом
содержал проводящий раствор соли NaCl.
На электроды импульсно подавалась разность потенциалов
, а внутренний объем липосом
содержал проводящий раствор соли NaCl.
На электроды импульсно подавалась разность потенциалов ![]() , при этом длительность импульса составляла
, при этом длительность импульса составляла
![]() , а зазор между электродами
составлял 1 см.
, а зазор между электродами
составлял 1 см.
|
|
|
|
Рисунок 9. Электронномикроскопические изображения суспензии нанокомпозитных липосом после воздействия электромагнитных импульсов. Изображение получено методом ПЭМ.
|
|
На Рис. 9 представлены изображения суспензии липосом после действия на нее электромагнитных импульсов, полученные методом ПЭМ. На представленных изображениях видны разрушенные липосомы, фрагменты их мембран, агрегаты наночастиц магнетита и характерные кубические кристаллы соли NaCl. Представляют интерес обнаруженные на этих изображениях новые объекты, которые образовались в результате высокоэнергетического электромагнитного воздействия - стержнеобразные наноструктуры (вискеры), характерные для оксидов железа, и плоские наноструктуры с отверстиями и четкими границами.
|
|
|
|
10.а. |
10.б. |
|
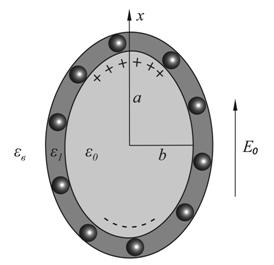
Рисунок 10. Воздействие импульсного электрического поля на нанокомпозитные липосомы, 10.а. Схема эксперимента по импульсному воздействию электрического поля, 10.б. Поляризация нанокомпозитной липосомы во внешнем электрическом поле. |
|
Для исследования возможности нетеплового воздействия имульсного электрического поля на нанокомпозитные липосомальные микрокапсулы, содержащие в своей оболочке адсорбированные наночастицы магнетита, и нахождения критических значений напряженности поля, приводящих к декапсуляции таких структур, рассмотрим следующий механизм взаимодействия липосом с внешним полем.
Рассматриваемый случай удовлетворяет
условию ![]() квазистационарности
электромагнитного поля [34]. Поэтому для нахождения величины электрического
поля
квазистационарности
электромагнитного поля [34]. Поэтому для нахождения величины электрического
поля ![]() , возникающего в цилиндрическом
контейнере, используем решение уравнение Пуассона для диэлектрического цилиндра
с диэлектрической проницаемостью воды
, возникающего в цилиндрическом
контейнере, используем решение уравнение Пуассона для диэлектрического цилиндра
с диэлектрической проницаемостью воды ![]() , окруженного диэлектрической
средой диэлектрической проницаемостью
, окруженного диэлектрической
средой диэлектрической проницаемостью ![]() , помещенного во внешнее однородное
электрическое поле
, помещенного во внешнее однородное
электрическое поле ![]() , [34].
, [34].
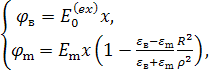 где
где
![]() , (1)
, (1)
![]() – электрический потенциал внутри
цилиндра,
– электрический потенциал внутри
цилиндра, ![]() - электрический потенциал вне
цилиндра,
- электрический потенциал вне
цилиндра, ![]() – напряженность электрического поля
внутри цилиндра,
– напряженность электрического поля
внутри цилиндра, ![]() - напряженность внешнего
электрического поля,
- напряженность внешнего
электрического поля, ![]() – радиус цилиндра,
– радиус цилиндра, ![]() –
цилиндрическая координата,
–
цилиндрическая координата, ![]() – пространственная координата,
перпендикулярная плоскостям электродов. Учитывая (1), находим, что
электрическое поле внутри цилиндрического контейнера однородно и величина его
напряженности в проведенном эксперименте составила
– пространственная координата,
перпендикулярная плоскостям электродов. Учитывая (1), находим, что
электрическое поле внутри цилиндрического контейнера однородно и величина его
напряженности в проведенном эксперименте составила ![]() . Таким образом, во время действия
электрического импульса водная суспензия нанокомпозитных липосом, оказалась
помещенной в пространственно однородное внешнее электрическое поле
. Таким образом, во время действия
электрического импульса водная суспензия нанокомпозитных липосом, оказалась
помещенной в пространственно однородное внешнее электрическое поле ![]() .
.
Оболочка используемых в
данной работе липосом состояла из двух типов амфифильных молекул
фосфотидилхолина и стеарилспермина (СС), при этом доля молекул СС составляла 20%.
Аминогруппы гидрофильной части молекул СС обладают свойством протонироваться в
водной фазе, приобретая при этом положительный заряд ![]() ,
равный по величине заряду электрона. Внутренний объем липосомы является
проводящим, поскольку содержит водный раствор соли NaCl. Оболочка липосомы
является диэлектриком с диэлектрической проницаемостью
,
равный по величине заряду электрона. Внутренний объем липосомы является
проводящим, поскольку содержит водный раствор соли NaCl. Оболочка липосомы
является диэлектриком с диэлектрической проницаемостью ![]() . В оболочку липосомы внедрены
проводящие наночастицы магнетита с формой близкой к
. В оболочку липосомы внедрены
проводящие наночастицы магнетита с формой близкой к
сферической с радиусом ![]() . Во время
действия электрического импульса такой
наноструктурированный липосомальный контейнер, окруженный водой, находится во
внешнем однородном электрическом поле
. Во время
действия электрического импульса такой
наноструктурированный липосомальный контейнер, окруженный водой, находится во
внешнем однородном электрическом поле ![]() . Вследствие действия внешнего
электрического поля форма липосомы может изменяться, сохраняя при этом
постоянный объем. Допустим, что форма липосомы изменяется от изначально
сферической до формы вытянутого эллипсоида вращения с наибольшей полуосью
параллельной внешнему полю
. Вследствие действия внешнего
электрического поля форма липосомы может изменяться, сохраняя при этом
постоянный объем. Допустим, что форма липосомы изменяется от изначально
сферической до формы вытянутого эллипсоида вращения с наибольшей полуосью
параллельной внешнему полю ![]()
Для изучения предела
устойчивости описанного липосомального контейнера во внешнем поле рассмотрим
задачу о поляризации слоистой эллипсоидальной среды во внешнем однородном
электрическом поле. Выберем эллипсоидальную систему координат с центром в
центре липосомы и наибольшей полуосью параллельной ![]() . В этом случае слоистая среда
состоит из следующих 3-х областей (Рис. 10.б.).
. В этом случае слоистая среда
состоит из следующих 3-х областей (Рис. 10.б.).
Область «0» -
внутренность вытянутого эллипсоида вращения с диэлектрической проницаемостью ![]() :
: ![]() ,
, ![]() ,
, ![]() ,
где
,
где ![]() - эллипсоидальные координаты,
- эллипсоидальные координаты, ![]() –
полуоси вытянутого эллипсоида вращения.
–
полуоси вытянутого эллипсоида вращения.
Область «1» -
эллипсоидальный слой с диэлектрической проницаемостью ![]() :
: ![]() ,
, ![]() ,
, ![]() .
.
Область «2» - внешность
эллипсоида с диэлектрической проницаемостью ![]() :
:![]() ,
, ![]() , 0
, 0![]() .
.
Решение для
электрического потенциала ![]() ищем в виде:
ищем в виде:
где
![]() ,
, ![]() –коэффициент
деполяризации,
–коэффициент
деполяризации, ![]() –
эксцентриситет,
–
эксцентриситет,
![]() ,
, ![]() .
.
Используя следующие граничные условия
вдали от центра эллипсоида при ![]() при
при ![]() (
(![]() );
);
на границе «0-1» ![]() ,
, ![]() ;
;
и на границе «1-2» ![]() ,
, ![]() ;
;
находим:
![]() ,
, ![]() ,
, ![]() ,
,
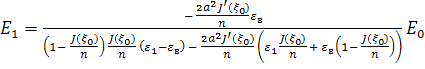 ,
,
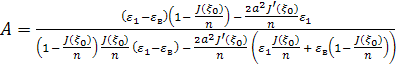 . (3)
. (3)
В случае проводящей
внутренности эллипсоида (область «0»), т.е. ![]() , а также тонкого эллиптического
, а также тонкого эллиптического ![]() слоя (область «1»), т.е.
слоя (область «1»), т.е. ![]() выражения
(3) принимают следующий вид:
выражения
(3) принимают следующий вид:
![]() – толщина эллиптического слоя,
– толщина эллиптического слоя, ![]() –
радиус шара с объемом, равным объему внутренней области эллипсоида, т.е.
–
радиус шара с объемом, равным объему внутренней области эллипсоида, т.е. ![]() .
.
Решение (2), (4) позволяет
найти напряженность электрического поля вблизи поверхности внутренней части
эллипсоида ![]() , где
, где ![]() ,
, ![]() – коэффициент Ламе,
– коэффициент Ламе, ![]() ,
, ![]() – единичный вектор нормали к
поверхности, в следующем виде:
– единичный вектор нормали к
поверхности, в следующем виде:
![]() , (5)
, (5)
которое вблизи полярной области (![]() ) принимает вид
) принимает вид
![]() , где
, где ![]() . (6)
. (6)
Полная энергия системы
во внешнем электрическом поле ![]() суммой энергий
суммой энергий
![]() – энергия проводящей
поляризованной внутренней части эллипсоида во внешнем поле,
– энергия проводящей
поляризованной внутренней части эллипсоида во внешнем поле, ![]() – энергия проводящих
поляризованных в локальном поле эллипсоида наночастиц, находящихся в области
«1»,
– энергия проводящих
поляризованных в локальном поле эллипсоида наночастиц, находящихся в области
«1», ![]() – энергия протонированных молекул
СС, обладающих положительным зарядом, находящихся в локальном поле вблизи
поверхности внутренней части эллипсоида, и
– энергия протонированных молекул
СС, обладающих положительным зарядом, находящихся в локальном поле вблизи
поверхности внутренней части эллипсоида, и ![]() – энергия поверхностного натяжения
оболочки липосомы.
– энергия поверхностного натяжения
оболочки липосомы.
Энергию ![]() находим из следующей формулы [34,
35]
находим из следующей формулы [34,
35]
![]() (8)
(8)
![]() ,
(9)
,
(9)
где использовано условие постоянства
объема эллипсоида
![]() .
.
В локальном поле вблизи
поверхности внутренней проводящей части эллипсоида (в области «1») находятся сферические
проводящие наночастицы радиуса ![]() . Индивидуальная энергия i-той
наночастицы
. Индивидуальная энергия i-той
наночастицы ![]() имеет вид
имеет вид
![]() , (10)
, (10)
а полная энергия всех наночастиц ![]() является суммой индивидуальных
энергий
является суммой индивидуальных
энергий ![]() , где N
–
число наночастиц в оболочке липосомы. Заменяя суммирование на интегрирование по
поверхности
, где N
–
число наночастиц в оболочке липосомы. Заменяя суммирование на интегрирование по
поверхности ![]() , где
, где ![]() – площадь, приходящаяся на одну
наночастицу,
– площадь, приходящаяся на одну
наночастицу, ![]() – площадь поверхности эллипсоида,
– площадь поверхности эллипсоида, ![]() ,
, ![]() ,
, ![]() – коэффициенты Ламе, получаем
– коэффициенты Ламе, получаем
![]() , где
(11)
, где
(11)
![]()
Энергия поверхностного
натяжения ![]() имеет следующий вид
имеет следующий вид
![]() , где (12)
, где (12)
![]() – коэффициент поверхностного
натяжения оболочки липосомы.
– коэффициент поверхностного
натяжения оболочки липосомы.
Протонированная молекула
СС, имеющая электрический заряд ![]() , находящаяся в
локальном поле
, находящаяся в
локальном поле ![]() (5) вблизи поверхности внутренней
части эллипсоида, обладает энергией
(5) вблизи поверхности внутренней
части эллипсоида, обладает энергией ![]() , а полная
энергия
, а полная
энергия ![]() является суммой энергий всех молекул
СС. Заменяя суммирование на интегрирование по поверхности липосомы
является суммой энергий всех молекул
СС. Заменяя суммирование на интегрирование по поверхности липосомы ![]() , где
, где ![]() – площадь поверхности липосомы,
приходящаяся на одну молекулу СС,
– площадь поверхности липосомы,
приходящаяся на одну молекулу СС, ![]() – площадь поверхности эллипсоида,
– площадь поверхности эллипсоида, ![]() , получаем
, получаем
![]() . (13)
. (13)
Полная энергия системы (7)
![]() является функцией эксцентриситета
является функцией эксцентриситета ![]() .
Для исследования вопроса о наличии или отсутствии локально устойчивых состояний
липосомы во внешнем поле
.
Для исследования вопроса о наличии или отсутствии локально устойчивых состояний
липосомы во внешнем поле ![]() найдем характер зависимости
найдем характер зависимости ![]() от эксцентриситета при малых
от эксцентриситета при малых ![]() .
Для этого разложим
.
Для этого разложим ![]() в ряд с точностью до
в ряд с точностью до ![]() :
:
![]() , где (14)
, где (14)
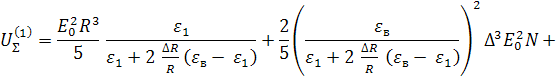
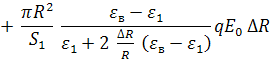
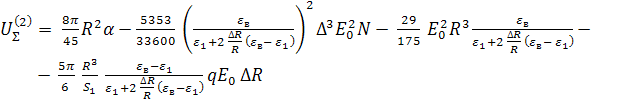 .
.
Из соотношения (14)
видно, что квадратичный по ![]() член разложения
член разложения ![]() отрицателен для любых значений
отрицателен для любых значений ![]() , а член четвертого порядка по
, а член четвертого порядка по ![]() меняет
знак в зависимости от величины
меняет
знак в зависимости от величины ![]() . Локально устойчивое состояние
системы существует при
. Локально устойчивое состояние
системы существует при ![]() и отсутствует при
и отсутствует при ![]() . Следовательно, уравнение
. Следовательно, уравнение
![]() (15)
(15)
определяет критическое значение
напряженности внешнего электрического поля ![]() , приводящего к потере устойчивости
системы. Из соотношений (14) и (15) следует, что при значениях внешнего поля
меньших критического
, приводящего к потере устойчивости
системы. Из соотношений (14) и (15) следует, что при значениях внешнего поля
меньших критического ![]() локально устойчивое состояние
системы существует, а при значениях внешнего поля больших критического
локально устойчивое состояние
системы существует, а при значениях внешнего поля больших критического ![]() локально устойчивое состояние
системы исчезает, т.е. происходит разрушение липосомы.
локально устойчивое состояние
системы исчезает, т.е. происходит разрушение липосомы.
Уравнение (15) для критического значения внешнего поля имеет следующее решение
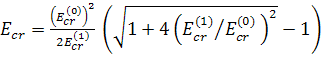 , где (16)
, где (16)
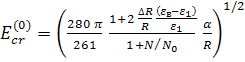 – критическое значение внешнего поля
без учета взаимодействия протонированных молекул СС с локальным полем вблизи
поверхности эллипсоида
– критическое значение внешнего поля
без учета взаимодействия протонированных молекул СС с локальным полем вблизи
поверхности эллипсоида ![]() ,
, 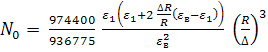 , a
, a
![]() - критическое значение внешнего поля
без учета взаимодействия проводящей поляризованной внутренней части эллипсоида с
внешним полем (
- критическое значение внешнего поля
без учета взаимодействия проводящей поляризованной внутренней части эллипсоида с
внешним полем (![]() ) и без учета взаимодействия поляризованных
наночастиц с локальным полем вблизи поверхности эллипсоида (
) и без учета взаимодействия поляризованных
наночастиц с локальным полем вблизи поверхности эллипсоида (![]() ).
).
Решение (16) принимает простой вид в частных случаях
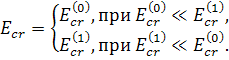 (17)
(17)
Для значений параметров
системы в рассматриваемом случае ![]() [36],
[36], ![]() [36],
[36], ![]() ,
, ![]() ,
, ![]() ,
, ![]() получаем
получаем ![]() ,
, ![]() . Следовательно, критическое
значение внешнего поля
. Следовательно, критическое
значение внешнего поля ![]() определяется энергией
взаимодействия протонированных молекул СС с локальным полем вблизи поверхности
внутренней части эллипсоида, при этом
определяется энергией
взаимодействия протонированных молекул СС с локальным полем вблизи поверхности
внутренней части эллипсоида, при этом
![]() , (18)
, (18)
а критическая разность потенциалов на
мембране липосомы в полярной области в этом случае составляет ![]() .
.
Значение (18)
определяет критическое значение внешнего поля, приводящего к разрыву вытянутой
поляризованной липосомы. Однако, существенный вклад в локальное (вблизи
проводящих наночастиц) разрушение оболочки липосомы вносит взаимодействие
заряженных протонированных молекул СС с поляризованными наночастицами. Энергия ![]() отдельной молекулы СС, находящейся
в локальном поле поляризованной наночастицы имеет вид
отдельной молекулы СС, находящейся
в локальном поле поляризованной наночастицы имеет вид
![]() . (19)
. (19)
С другой стороны, доля
поверхностной энергии ![]() , приходящейся на одну молекулу СС
равна
, приходящейся на одну молекулу СС
равна
![]() , (20)
, (20)
где ![]() – площадь, приходящейся на одну
молекулу СС. Из условия
– площадь, приходящейся на одну
молекулу СС. Из условия ![]() равенства энергии взаимодействия протонированной
молекулы СС с поляризованной наночастици и поверхностной энергии, приходящейся
на одну молекулу СС, находим критическое значение внешнего поля
равенства энергии взаимодействия протонированной
молекулы СС с поляризованной наночастици и поверхностной энергии, приходящейся
на одну молекулу СС, находим критическое значение внешнего поля ![]() , локально (вблизи проводящих
наночастиц) разрушающего оболочку липосомы
, локально (вблизи проводящих
наночастиц) разрушающего оболочку липосомы
![]() . (21)
. (21)
Для выше использованных
значений параметров рассматриваемой системы и ![]() [36] критическое значение внешнего
поля и разность потенциалов на мембране липосомы
[36] критическое значение внешнего
поля и разность потенциалов на мембране липосомы ![]() равны
равны
![]() ,
, ![]() (22)
(22)
Следовательно,
критическое значение внешнего поля (21), при котором локально разрушается
оболочка липосомы вблизи наночастиц, оказывается меньше критического значение
внешнего поля (18) ![]() , а их отношение оказывается равным
, а их отношение оказывается равным
![]() (23)
(23)
для значений параметров рассматриваемой системы.
Таким образом, соотношение (23) показывает, что наличие проводящих наночастиц в оболочке липосомы снижает критическое значение внешнего электрического поля, необходимого для декапсуляции липосомы.
В проведенном
эксперименте по декапсуляции нанокомпозитных липосом напряженность
электрического поля в водной суспензии липосом составила ![]() и оказалась больше критического
значения
и оказалась больше критического
значения ![]() (22), но меньше критического
значения
(22), но меньше критического
значения ![]() (18)
(18)
![]() (24)
(24)
Соотношение (24) для критических значений поля и величины поля, использованного в эксперименте, хорошо согласуются с полученными результатами по декапсуляции нанокомпозитных липосом.
Таким образом, предложен механизм, описывающий взаимодействие наноструктурированных липосом, содержащих на поверхности проводящие наночастицы, с внешним нетепловым электрическим полем, который приводит к существенному изменению структуры липосомы. Получены оценки критических значений внешнего, электрического поля, приводящего к декапсуляции нанокомпозитных липосом. Показано, что наличие в оболочке липосом проводящих наночастиц существенно снижает критическую величину внешнего электрического поля, разрушающего нанокомпозитные липосомы.
С целью дальнейшей функционализации нанокомпозитных липосом и модификации их механических и физико-химических характеристик были проведены эксперименты по формированию полимерного слоя на их поверхности. В качестве полимера был использован полианионполистиролсульфонат, использовавшийся ранее в многочисленных работах для создания полиэлектролитных пленок и капсул методом чередующейся послойной адсорбции противоположно заряженных полиэлектрорлитов. Процесс адсорбции отрицательно заряженных молекул ПСС на поверхности катионных липосом регистрировали с помощью измерения ζ-потенциала получаемых коллоидных наноструктур (Рис. 12). Как видно из графика зависимости величины ζ-потенциала от концентрации полианиона ПСС в суспензии липосом, при увеличении концентрации ПСС происходит перезарядка изначально положительно-заряженных липосом вследствие адсорбции на их поверхность отрицательно-заряженных молекул полианиона ПСС. При концентрациях ПСС более 25×10-5 М (в расчете на мономер) величина поверхностного потенциала достигает величины -25 мВ и дальнейшее уменьшение потенциала не происходит, т.е. наблюдается насыщение связывания.
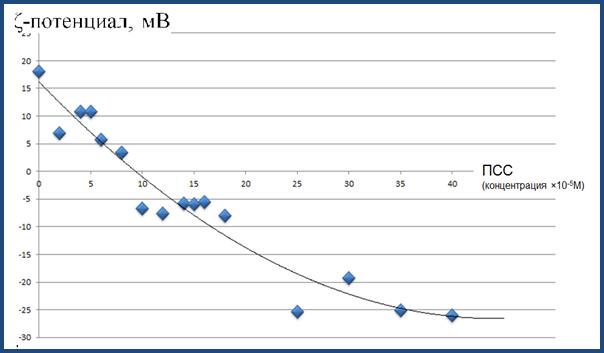
Рисунок 12. Зависимость ζ-потенциала в суспензии липосом от концентрации молекул ПСС.
Предварительные эксперименты по капсулированию NaCl в нанокомпозитных липосомах, покрытых слоем полимера (ПСС), указывают на то, что такие структуры могут быть более устойчивы к воздействию электромагнитных импульсов. Импульсные воздействия, приводившие к полному разрушению липосом, не покрытых слоем полимера, приводили лишь к частичному разрушению нанокомпозитных везикул, имеющих полимерный слой на внешней поверхности.
4. Заключение и выводы
В настоящей работе с целью создания объектов, чувствительных к внешнему нетепловому электромагнитному воздействию, были успешно синтезированы новые нанокомпозитные липосомы с размерами до 300 нм из молекул стеарилспермина и фосфатидилхолина. Показана возможность формирования на поверхности нанокомпозитных липосом слоев полимеров, существенно увеличивающих стабильность липосом и их устойчивость к внешним воздействиям. Оболочки синтезированных липосом были функционализированы проводящими магнитными наночастицами (магнетита) с характерным размером 6-8 нм. Показано, что наличие наночастиц магнетита в оболочке полученных липосом обеспечивает эффективные возможности влияния на структуру таких липосом внешним нетепловым импульсным электрическим воздействием, помимо возможности управления пространственной локализацией липосом внешним магнитным полем. Для дополнительного контроля эффекта декапсуляции, возникающего вследствие нетеплового импульсного электромагнитного воздействия на полученные нанокомпозитные липосомы, в их внутренний объем был помещен раствор NaCl.
Предложен механизм, описывающий взаимодействие наноструктурированных липосом, содержащих на поверхности проводящие наночастицы, с внешним импульсным электрическим полем, который приводит к существенному изменению структуры липосомы. Получены оценки критических значений внешнего электрического поля, приводящего к декапсуляции нанокомпозитных липосом. Экспериментально показана возможность декапсуляции полученных нанокомпозитных гибридных липосом с помощью коротких биполярных электрических импульсов. Экспериментально продемонстрирован и теоретически описан эффект снижения критических значений напряженностей электрического поля, вызывающих декапсуляцию нанокомпозитных гибридных липосом, в результате наличия в их оболочках проводящих наночастиц. Полученные результаты указывают на возможность создания нанокомпозитных гибридных липосом и везикул на основе комплексов липидов, полимеров и наночастиц, пространственная локализация которых, а также структура и проницаемость оболочек, может изменяться контролируемым образом с помощью нетеплового электромагнитного воздействия. Такие наносистемы могут являться основой для создания новых эффективных средств капсулирования, адресной доставки и управляемого высвобождения различных веществ в водных средах, перспективных для био-медицинских и других применений.
Работа поддержана Российским Научным Фондом, проект 14-12-01379.
Литература
1. A.I. Freeman, E. Mayhew, Targeted drug delivery // Cancer, 1986, Vol. 58(S2), 573–583.
2. Svenson, Sonke; Prud'homme, Robert K. (Eds.), Multifunctional Nanoparticles for Drug Delivery Applications: Imaging, Targeting, and Delivery Series // Nanostructure Science and Technology, Springer, 2012, 373p.
3. S. Parveen, R. Misra, S.K. Sahoo, Nanoparticles: a boon to drug delivery, therapeutics, diagnostics and imaging // Nanomedicine: Nanotechnology, Biology and Medicine, 2012, Vol.8(2), 147-166.
4. K. Kataokaa, A. Haradaa, Y. Nagasaki, Block copolymer micelles for drug delivery: design, characterization and biological significance // Advanced Drug Delivery Reviews, 2001, Vol.47(1), 113–131.
5. Nasongkla N, Bey E, Ren J, Ai H, Khemtong C, Guthi JS, Chin SF, Sherry AD, Boothman DA, Gao J., Multifunctional polymeric micelles as cancer-targeted, MRI-ultrasensitive drug delivery systems // NanoLett. 2006, Vol. 6(11),:2427-30.
6. A.Z. Wang, R. Langer, O.C. Farokhzad, Nanoparticle Delivery of Cancer Drugs // Annual Review of Medicine, 2012, Vol.63, 185-198.
7. E.Donath, G.B.Sukhorukov, F.Caruso, S.A.Devis, H.Möhwald // Angew.Chem. Int. Ed. Engl. 37 (1998) 2202.
8. G.B. Sukhorukov, E. Donath, S.A. Davis, Lichtenfeld, F. Caruso, V.I. Popov, H. Möhwald // Polym. Adv. Technol. 9 (1998) 759.
9. Radtchenko I.L., Sukhorukov G.B., Leporatti S., Khomutov G.B., Donath E., Mohwald H., Assembly of alternated multivalent ion/polyelectrolyte layers on colloidal particles. Stability of the multilayers and encapsulation of macromolecules into polyelectrolyte capsules // J. Colloid. Interface Sci., 2000, V.230(2), p.272-280.
10. G.B. Sukhorukov, A. Antipov, A. Voigt, E. Donath, H. Möhwald pH-Controlled Macromolecule Encapsulation in and Release from Polyelectrolyte Multilayer Nanocapsules // Macromol. Rapid Commun., 2001, Vol.22, 44-46.
11. A.G. Skirtach, A.A. Antipov, D.G. Shchukin, G.B. Sukhorukov, Remote activation of capsules containing Ag nanoparticles and IR dye by laser light // Langmuir, 2004, Vol.20, 6988-6992.
12. B. Radt, T.A. Smith, F. Caruso, Optically Addressable Nanostructured Capsules // Adv. Mater. 2004, Vol.16, 2184-2189.
13. Z. Lu, M.D. Prouty, Z..Guo, V.O. Golub, C.S.S.R. Kumar, Y.M. Lvov // Langmuir, 2005, Vol.21, 2042-2050.
14. D. A. Gorin, D. G. Shchukin, A. I. Mikhailov, K. Kohler, S. A. Sergeev, S. A. Portnov, I. V. Taranov, V. V. Kislov, and G. B. Sukhorukov, Effect of Microwave Radiation on Polymer Microcapsules Containing Inorganic Nanoparticles // Technical Physics Letters, 2006, Vol. 32, No. 1, pp. 70–72
15. Gorin D.A., Shchukin D.G., KoksharovYu.A., Portnov S.A., Köhler K., Taranov I.V., Kislov V.V., Khomutov G.B., Möhwald H., Sukhorukov G.B., Effect of microwave irradiation on composite iron oxide nanoparticle/polymer microcapsules // Proceedings of SPIE, 2007, Vol.6536, №653604.
16. Schwendener R.A., Liposomes in biology and medicine // Adv. Exp. Med. Biol. 2007, Vol.620, 117-28.
17. D.D. Lasic, Liposomes: from physics to applications // Elsevier, Amsterdam, New York, 1993, 575 p.
18. A. Wagner, K. Vorauer-Uhl, Liposome Technology for Industrial Purposes // Journal of Drug Delivery, 2011, Article ID 591325, 9 p.
19. G.A. Koning, A.M.M. Eggermont, Lars.H. Lindner, T.L.M. ten Hagen, Hyperthermia and Thermosensitive Liposomes for Improved Delivery of Chemotherapeutic Drugs to Solid Tumors // Springer Pharm Res., 2010, P.1750-1754.
20. R. Ranganathan1, S. Madanmohan, A. Kesavan, G. Baskar, Y. Ramia, Krishnamoorthy, R. Santosham, D. Ponraju, S.K. Rayala, G. Venkatraman, Nanomedicine towards development of patient-friendly drug-delivery systems for oncological applications // International Journal of Nanomecine, 2012, P.1043–1060.
21. Widder K.J., Senyei A.E., Scarpelli D.G. Magnetic microspheres:a model system for site specific drug delivery in vivo // Proc. Soc. Exp. Biol. Med., 1978., Vol.58. 141—146.
22. Giersig M., Khomutov G.B., (Editors.), Nanomaterials for application in medicine and biology // Springer, Dordrecht, The Netherlands, 2008, 188p.
23. Губин С.П., Кокшаров Ю.А., Хомутов Г.Б., Юрков Г.Ю., Магнитные наночастицы: методы получения, строение и свойства // Успехи химии, 2005, т.74, №6, c.539-574.
24. Amstad E, Textor M, Reimhult E., Stabilization and functionalization of iron oxide nanoparticles for biomedical applications // Nanoscale, 2011, Vol.3(7), 2819-43.
25. A. Kumar Gupta,M. Gupta, Synthesis and surface engineering of iron oxide nanoparticles for biomedical applications // Biomaterials, 2005, Vol.26, 3995–4021.
26. Berry C., Curtis A. Functionalisation of magnetic nanoparticles for applications in biomedicine // J. Phys. D: Appl. Phys., 2003, 36, R198–R206.
27. Lu A.-H., Salabas E.L., Schuth F., Magnetic nanoparticles: synthesis, protection, functionalization, and application // Angew. Chem. Int. Ed. 2007, p.1222-1244.
28. J. Kim, H.S. Kim, Multifunctional Uniform Nanoparticles Composed of a Magnetite Nanocrystal Core and a Mesoporous Silica Shell for Magnetic Resonance and Fluorescence Imaging and for Drug Delivery // Angewandte Chemie International Edition, 2008, Vol.47(44), 8438–8441.
29. A. Gupta, Surface-modified superparamagnetic nanoparticles for drug delivery: preparation, characterization, and cytotoxicity studies // 2004, IEEE Trans Nanobioscience, 3(1), 66-73.
30. A. Akbarzadeh, M. Samiei, S. Davaran, Magnetic nanoparticles preparation, physical properties, and applications in biomedicine // Nanoscale Research Letters, 2012, p. P.144.
31. Strijkers G.J., Kluza E., Van Tilborg G.A., van der Schaft D.W., Griffioen A.W., Mulder W.J., Nicolay K., Paramagnetic and fluorescent liposomes for target-specific imaging and therapy of tumor angiogenesis // Angiogenesis, 2010, 13(2), 161–173.
32. Massart R. // IEEE Trans. Magn. 1981, MAG-17, 1247−1248.
33. G.B. Khomutov, Y.A. Koksharov, Organized ensembles of magnetic nanoparticles: preparation, structure and properties, In: “Magnetic Nanoparticles”, Edited by S.P. Gubin, WILEY-VCH Verlag GmbH & Co. KGaA, Weinheim, 2009, p.p.117-195.
34. Л.Д. Ландау, Е.М. Лифшиц // Электродинамика сплошных сред, Москва, ФИЗМАТЛИТ, 2003, 651 стр.
35. В.В. Батыгин, И.Н.Топтыгин // Сборник задач по электродинамике, Москва: НИЦ «Регулярная и хаотическая динамика», 2002, 640 стр.
36. V. P. Kim, A. V. Ermakov, E. G. Glukhovskoy, A. A. Rakhnyanskaya, Yu. V. Gulyaev, V. A. Cherepenin, I. V. Taranov, P. A. Kormakova, K. V. Potapenkov, N. N. Usmanov, A. M. Saletsky, Yu. A. Koksharov, and G. B. Khomutov, Planar Nanosystems on the Basis of Complexes Formed by Amphiphilic Polyamine, Magnetite Nanoparticles, and DNA Molecules // Nanotechnologies in Russia, 2014, Vol. 9, Nos. 5–6, 280–287.