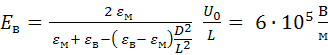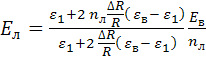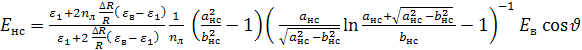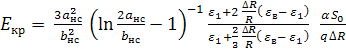ДИСТАНЦИОННАЯ АКТИВАЦИЯ УЛЬТРАКОРОТКИМИ ЭЛЕКТРИЧЕСКИМИ ИМПУЛЬСАМИ ЛИПОСОМАЛЬНЫХ КАПСУЛ, СОДЕРЖАЩИХ ЗОЛОТЫЕ НАНОСТЕРЖНИ
Ю. В. Гуляев 1, В. А. Черепенин 1, И. В. Таранов 1, В. А. Вдовин 1, А. А. Ярославов 1, 2, В. П. Ким 1, 3, Г. Б. Хомутов 1, 3
1 Институт радиотехники и электроники им. В.А. Котельникова РАН
2 Химический факультет МГУ им. М.В. Ломоносова
3 Физический факультет МГУ им. М.В. Ломоносова
Статья поступила в редакцию 2 ноября 2015 г.
Аннотация. Обнаружен эффект декапсуляции нанокомпозитнных липосомальных капсул, содержащих анизотропные наночастицы (наностержни) золота, вызванный воздействием на них ультракоротких электрических импульсов. Описан механизм разрушения липосомальной оболочки капсул вблизи полюсов проводящих золотых наностержней в результате импульсного электрического воздействия. Получено выражение для критического значения напряженности импульсного электрического поля, определяющего порог возникновения данного эффекта, численное значение которого согласуется с полученными экспериментальными данными. Экспериментально показано, что обнаруженный эффект декапсуляции обусловлен наличием золотых наностержней, связанных с липосомальной оболочкой капсул, и не возникает при их отсутствии.
Ключевые слова: капсула, липосомы, структура, золотые наностержни, полиэлектролиты, импульсное электрическое поле.
Abstract. The effect of decapsulation of nanocomposite liposomal capsules containing anisotropic gold nanoparticles (nanorods) caused by their treatment using ultrashort external electric field pulses have been discovered. The mechanism of the liposome capsule shell destruction in the pole areas of conductive gold nanorods caused by external pulsed electrical stimulation was described. An expression for the critical value of the applied pulsed electric field which determines the threshold for the onset of the decapsulation effect have been obtained. The theoretical calculated numerical value of threshold pulsed electric field was consistent with the obtained experimental data. It was shown experimentally that the observed decapsulation effect was caused by the presence of gold nanorods bound with the liposomal capsule shell, and that the decapsulation effect did not occur in liposomes in the absence of gold nanorods.
Keywords: capsule, liposomes, structure, gold nanorods, polyelectrolytes, pulse electric field.
Введение
Возможность осуществления контролируемой адресной доставки лекарственных средств занимает существенное место среди современных исследований в области нанотехнологий. Одним из перспективных подходов к решению этой задачи является создание систем для инкапсулирования, адресной доставки и контролируемого высвобождения лекарств в заданном месте организма [1-4].
Проблема эффективного и при этом безопасного для окружающих биологических структур высвобождения инкапсулированного вещества из контейнера является наиболее сложной и актуальной. Ее решению посвящены работы по изменению проницаемостью оболочек контейнеров при помощи лазерного излучения, микроволновых полей, переменного магнитного поля, изменению химического состава окружающей среды [5-11]. Одним из наиболее перспективных подходов к созданию лекарственных контейнеров, чувствительных к электромагнитному внешнему воздействию, является использование в его нанокомпозитной структуре неорганических частиц. Неорганические наночастицы различной природы и состава (металлические, магнитные, полупроводниковые), как правило, обладают набором физических и химических свойств, существенно отличающихся от свойств соответствующих макрообъемных материалов. Это качество делает такие наночастицы уникальными и интереснейшими объектами фундаментальных исследований, а также важнейшими функциональными компонентами перспективных устройств и технологий. Так, с использованием металлических нанокластеров был впервые создан одноэлектронный туннельный транзистор, функционирующий при комнатной температуре [12-14]. Металлические и магнитные наночастицы широко используются в нано-биомедицинских технологиях для целей диагностики и терапии [15, 16]. Включение магнитных наночастиц в состав оболочек полиэлектролитных капсул позволило обеспечить чувствительность таких капсул к внешнему микроволновому воздействию, контролируемым образом изменяющим структуру и проницаемость оболочек таких капсул [9-11].
Металлические и полупроводниковые наночастицы с существенно вытянутой формой (наностержни), а также их организованные ансамбли обладают анизотропными оптическими свойствами. C использованием молекул ДНК в качестве адсорбирующей матрицы были созданы квазилинейные структуры из полупроводниковых наностержней CdSe, флуоресценция которых носила существенно поляризованный характер [13, 17].
В данной работе на основе методики [18] были синтезированы липосомальные нанокомпозитные капсулы, содержащие наностержни золота, чувствительные к внешнему импульсному электрическому воздействию. Длительность использованного электрического воздействия составляла около 8 нс. В соответствии с [19], импульсы такой длительности будем называть ультракороткими. Обнаружен эффект декапсуляции синтезированных капсул, вызванный воздействием на них ультракоротких электрических импульсов.
1. Получения липосомальных нанокомпозитных капсул
Для синтеза капсул использовали амфифильные соединения фосфатидилхолина и стеарилспермина (СС). При этом доля молекул СС в оболочке полученных липосомальных капсул составляла 1/5 часть. Водная суспензия золотых наностержней, имеющих характерные размеры: средняя длина 90 нм, средний диаметр 10 нм, была приобретена у компании Sigma-Aldrich. С целью обеспечения коллоидной стабильности наностержней (для предотвращения их агрегации) в суспензии наностержней присутствовало катионное поверхностно-активное вещество цетилтриметиламмоний бромид. Наностержни золота связывались с оболочками предварительно полученных стандартным ультразвуковым методом липосом, состоящих из молекул биогенного липида (фосфатидилхолин) и амфифильного соединения СС в соотношении 4:1. Внутренний объем капсулы заполняли раствором соли NaCl стандартным методом при использовании процедуры диализа. Структуру синтезированых липосомальных нанокомпозитных капсул исследовали методами просвечивающей электронной микроскопии (ПЭМ). Характерное изображение липосомальной капсулы, содержащей золотые наностержни, представлено на Рис. 1.
|
|
|
Рис. 1. Электронно-микроскопическое изображение нанокомпозитной липосомальной капсулы, содержащей наностержни золота. |
2. Воздействие ультракоротких электрических импульсов на липосомальные нанокомпозитные капсулы
Были изучены возможности дистанционной активации
нанокомпозитных липосомальных капсул, содержащих наностержни золота, при помощи ультракоротких электрических
импульсов. Импульсное воздействие электрического поля на водную
суспензию синтезированных липосомальных капсул осуществляли следующим образом
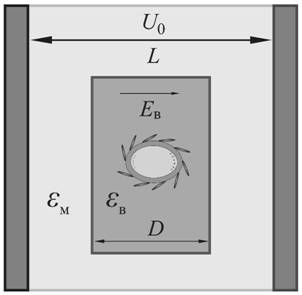
(Рис.2). Между плоскими электродами с зазором ![]() помещали трансформаторное масло с относительной диэлектрической
проницаемостью
помещали трансформаторное масло с относительной диэлектрической
проницаемостью ![]() , в котором находился цилиндрический контейнер толщиной
, в котором находился цилиндрический контейнер толщиной ![]() с водной суспензией липосомальных капсул
с характерным размером
с водной суспензией липосомальных капсул
с характерным размером ![]() . Оболочки липосомальных мембран были связаны с проводящими наностержнями золота c характерной длиной
. Оболочки липосомальных мембран были связаны с проводящими наностержнями золота c характерной длиной ![]() и средним диаметром
и средним диаметром ![]() , а внутренний объем контейнеров
содержал проводящий раствор NaCl.
На электроды подавали импульсы напряжения
, а внутренний объем контейнеров
содержал проводящий раствор NaCl.
На электроды подавали импульсы напряжения ![]() длительностью
длительностью ![]() .
.
|
|
|
Рис. 2. Схема воздействия ультракоротких электрических импульсов на водную суспензию липосомальных нанокомпозитных капсул. |
Эффект декапсуляции нанокомпозитных липосомальных капсул, содержащих
наностержни золота, был
зарегистрирован методом кондуктометрии по изменению проводимости водной
суспензии липосом. При декапсуляции содержащаяся
внутри липосомальных капсул соль NaCl высвобождалась в окружающую воду, увеличивая при этом
удельную проводимость суспензии. Удельная проводимость суспензии до воздействия
ультракоротких электрических импульсов
составляла ![]() , а после воздействия --
, а после воздействия -- ![]() . Удельная проводимость суспензии, соответствующая декапсуляции всех
липосомальных капсул (достигавшаяся при помощи добавления детергента тритон
X100), составила
. Удельная проводимость суспензии, соответствующая декапсуляции всех
липосомальных капсул (достигавшаяся при помощи добавления детергента тритон
X100), составила ![]() . Не полная декапсуляция суспензии объясняется тем, что не все липосомальные
капсулы были связаны с наностержнями
золота. Аналогичное воздействие на водную суспензию липосомальных капсул, не содержащих наностержни золота, не приводило к
заметному изменению ее удельной проводимости.
. Не полная декапсуляция суспензии объясняется тем, что не все липосомальные
капсулы были связаны с наностержнями
золота. Аналогичное воздействие на водную суспензию липосомальных капсул, не содержащих наностержни золота, не приводило к
заметному изменению ее удельной проводимости.
|
|
|
Рис. 3. Электронно-микроскопическое изображение нанокомпозитных липосомальных капсул после воздействия ультракоротких электромагнитных импульсов. |
Эффект декапсуляции нанокомпозитных липосомальных капсул, содержащих наностержни золота, был независимо подтвержден методом ПЭМ. На Рис. 3 представлено характерное изображение нанокомпозитных липосомальных капсул после воздействия ультракоротких электромагнитных импульсов. На изображении видны разрушенные липосомы, фрагменты их мембран, агрегации наностержней золота. Изменения структуры липосомальных капсул, не содержащих наностержни золота, после аналогичного воздействия методами ПЭМ обнаружено не было.
Для нахождения критического значения напряженности поля, приводящего к декапсуляции нанокомпозитных липосомальных капсул, оболочки которых связаны с проводящими наностержнями золота, рассмотрим возможный механизм разрушения их оболочек, инициированный внешним электрическим полем.
Для указанных выше
значений ![]() и
и ![]() выполняется условие квазистационарности
электромагнитного поля
выполняется условие квазистационарности
электромагнитного поля ![]() (с – скорость света) [20].
Длительность электрического импульса удовлетворяет также условиям
(с – скорость света) [20].
Длительность электрического импульса удовлетворяет также условиям
где ![]() – удельные проводимости водных
солевых растворов вне и внутри капсул. В этом случае внутренний раствор капсулы
можно считать проводящим, внешний – диэлектриком.
– удельные проводимости водных
солевых растворов вне и внутри капсул. В этом случае внутренний раствор капсулы
можно считать проводящим, внешний – диэлектриком.
В водной среде молекулы
СС, входящие в оболочку капсулы, способны приобретать положительный заряд ![]() , равный по величине заряду электрона. Оболочка
капсулы является диэлектриком с диэлектрической проницаемостью
, равный по величине заряду электрона. Оболочка
капсулы является диэлектриком с диэлектрической проницаемостью ![]() , к ней присоединены проводящие
наностержни золота, имеющие сильно вытянутую форму. Во время действия
электрического импульса такая липосомальная
капсула, окруженная водой, оказывается во внешнем электрическом поле
, к ней присоединены проводящие
наностержни золота, имеющие сильно вытянутую форму. Во время действия
электрического импульса такая липосомальная
капсула, окруженная водой, оказывается во внешнем электрическом поле ![]() . Поле
. Поле ![]() можно найти как решение уравнения Лапласа для
диэлектрического цилиндра с проницаемостью равной проницаемости воды
можно найти как решение уравнения Лапласа для
диэлектрического цилиндра с проницаемостью равной проницаемости воды ![]() , окруженного диэлектрической средой
с проницаемостью
, окруженного диэлектрической средой
с проницаемостью ![]() , помещенного во внешнее однородное
электрическое поле (Рис. 4):
, помещенного во внешнее однородное
электрическое поле (Рис. 4):
Ранее было показано [19, 21], что форма липосомальной капсулы под действием внешнего электрического поля может меняться от сферической до эллипсоидальной. Используя решение задачи о распределении электрического поля в слоистой эллипсоидальной среде [19-21], находим напряженность электрического поля вблизи полярной области вытянутой липосомальной капсулы
где
![]()
– коэффициент деполяризации, ![]() – эксцентриситет,
– эксцентриситет, ![]() – главные полуоси эллипсоида,
– главные полуоси эллипсоида, ![]() – толщина липосомальной мембраны,
– толщина липосомальной мембраны, ![]() – радиус шара с объемом, равным объему липосомы.
– радиус шара с объемом, равным объему липосомы.
|
|
|
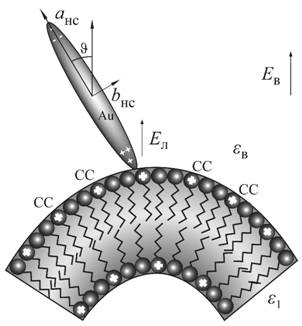
Рис. 4. Схема взаимодействия протонированных молекул стеарилспермина (СС) с поляризованным наностержнем. |
На поверхности липосомы находится
проводящий наностержень золота (Рис. 4), который поляризуется в поле ![]() (3) и локально изменяет
электрическое поле в своей окрестности. Будем считать, что его форма близка в
форме вытянутого эллипсоида вращения с главными полуосями
(3) и локально изменяет
электрическое поле в своей окрестности. Будем считать, что его форма близка в
форме вытянутого эллипсоида вращения с главными полуосями ![]() . Для проводящего эллипсоида
вращения, помещенного во внешнее электрическое поле, напряженность электрического
поля вблизи полюса наностержня, расположенного в полярной области липосомальной
капсулы, определяется следующим выражением
. Для проводящего эллипсоида
вращения, помещенного во внешнее электрическое поле, напряженность электрического
поля вблизи полюса наностержня, расположенного в полярной области липосомальной
капсулы, определяется следующим выражением
где ![]() – эксцентриситет эллипсоидального
наностержня,
– эксцентриситет эллипсоидального
наностержня, ![]() – угол между большей главной
полуосью эллипсоида и нормалью к поверхности липосомы.
– угол между большей главной
полуосью эллипсоида и нормалью к поверхности липосомы.
В локальном поле (4) вблизи
полюса наностержня находятся протонированные молекулы СС липосомального бислоя,
обладающие единичным положительным зарядом ![]() [22]. Взаимодействие поляризованного наностержня с
заряженными молекулами СС может приводить к локальному разрушению оболочки липосомальной
капсулы, если внешнее поле
[22]. Взаимодействие поляризованного наностержня с
заряженными молекулами СС может приводить к локальному разрушению оболочки липосомальной
капсулы, если внешнее поле ![]() превысит критическое значение
превысит критическое значение ![]()
Величину критического значения
электрического поля ![]() можно найти из условия равенства работы
по перемещению молекулы СС в локальном поле наностержня за пределы
липосомального бислоя
можно найти из условия равенства работы
по перемещению молекулы СС в локальном поле наностержня за пределы
липосомального бислоя ![]() и доли поверхностной энергии
и доли поверхностной энергии ![]() , приходящейся на одну молекулу СС,
где
, приходящейся на одну молекулу СС,
где ![]() – площадь, занимаемая одной
молекулой СС,
– площадь, занимаемая одной
молекулой СС, ![]() – коэффициент поверхностного
натяжения оболочки липосомальной капсулы. Для случая слабо вытянутой липосомальной
капсулы (
– коэффициент поверхностного
натяжения оболочки липосомальной капсулы. Для случая слабо вытянутой липосомальной
капсулы (![]() ) и сильно вытянутого наностержня (
) и сильно вытянутого наностержня (![]() ) и
) и ![]() получаем выражение для критического
поля:
получаем выражение для критического
поля:
которое принимает значение ![]() для параметров рассматриваемого
случая:
для параметров рассматриваемого
случая: ![]() ,
, ![]() [22],
[22], ![]() ,
, ![]() ,
, ![]() ,
, ![]() ,
, ![]() .
.
В
проведенном эксперименте значение электрического поля в водной суспензии липосомальных
капсул составило ![]() и, следовательно, условие (5)
оказалось выполненным. Таким образом, в данном случае реализован эффект
декапсуляции нанокомпозитных липосомальных капсул вследствие локального
разрушения их оболочек вблизи полюсов вытянутых проводящих наностержней.
и, следовательно, условие (5)
оказалось выполненным. Таким образом, в данном случае реализован эффект
декапсуляции нанокомпозитных липосомальных капсул вследствие локального
разрушения их оболочек вблизи полюсов вытянутых проводящих наностержней.
Заключение
Обнаружен эффект декапсуляции нанокомпозитных липосомальных капсул, содержащих наностержни золота, вызванный воздействием на них ультракоротких электрических импульсов. Описан механизм разрушения оболочки липосомальной капсулы вблизи полюса вытянутого проводящего наностержня в результате импульсного электрического воздействия. Получено выражение для критического значения напряженности электрического поля, определяющего порог возникновения данного эффекта. Величина критического поля хорошо согласуется с экспериментальными данными. Показано, что обнаруженный эффект декапсуляции обусловлен наличием проводящих золотых наностержней в оболочке капсул и не возникает при их отсутствии. Это обстоятельство указывает на избирательность использованного воздействия. Такая избирательность воздействия очень важна для практических применений, связанных с управляемой доставкой лекарств в организме, поскольку позволяет избежать повреждений клеточных мембран организма, обеспечивая изменения структуры только у оболочек нанокомпозитных липосомальных капсул.
Работа выполнена при поддержке Российского научного фонда (проект 14-12-01379).
Литература
1. Multifunctional Nanoparticles for Drug Delivery Applications: Imaging, Targeting, and Delivery Series/ Eds by Svenson S, Prudhomme R.K. N.Y.:Springer, 2012.
2. Parveen S., Misra R., Sahoo S.K. // Nanomedicine: Nanotechnology, Biology and Medicine. 2012. V.8. №2. P.147.
3. Nasongkla N., Bey E., Ren J. et al. // Nano Lett. 2006. V. 6. №11. P.2427.
4. Wang A.Z., Langer R., Farokhzad O.C. // Annual Rev. Medicine. 2012. V.63. P.185.
5. Radt B., Smith T.A., Caruso F.//Advanced Materials. 2004. V.16. №23-24. P.2184.
6. Lu Z., Prouty M.D., Guo Z. et al.// Langmuir. 2005. V.21.№5. P.2042.
7. Skirtach A.G., Antipov A.A., Shchukin D.G., Sukhorukov G.B. // Langmuir. 2004. V.20. №17. P.6988.
8. Amstad E., Kohlbrecher J., Muller E., Schweizer T., Textor M., and Reimhult E. // Nano Letters, 2011. V.11, P.1664.
9. D. A. Gorin, D. G. Shchukin, A. I. Mikhailov, K. Köhler, S. A. Sergeev, S. A. Portnov, I. V. Taranov, V. V. Kislov, and G. B. Sukhorukov // Technical Physics Letters, 2006, Vol. 32, N. 1, p. 70–72.
10. Гуляев Ю.В., Черепенин В.А., Таранов И.В. и др. // Журнал радиоэлектроники [электронный журнал]. 2014. № 12. URL: http://jre.cplire.ru/jre/dec14/25/text.pdf
11. Yu.V. Gulyaev, V.A. Cherepenin, V.A. Vdovin, I.V. Taranov, G.B. Sukhorukov, D.A. Gorin, and G.B. Khomutov // Journal of Communications Technology and Electronics, 2015, Vol. 60, No. 11, pp. 1286–1290.
12. Gubin S.P., Gulyaev Yu.V., Khomutov G.B. et al. // Nanotechnology. 2002, V.13. №2. P.185.
13. Кислов В.В., Колесов В.В., Таранов И.В.//Радиотехника и электроника, 2002, Т.47, № 11. С.1385.
14. Kislov V., Medvedev B., Gulyaev Yu.et al. // Int. J. Nanoscience. 2007. V. 6. № 5. P. 373.
15. Gupta A.K., Gupta M. // Biomaterials. 2005. V.26. №18. P.3995.
16. Koning G.A., Eggermont A.M.M., Lindner L.H., ten Hagen T.L.M. // Pharmaceutical Research. 2010. V. 27. № 8. p. 1750.
17. Artemyev M., Kisiel D., Abmiotko S. et al.// J. Amer. Chemical Soc. 2004. V. 126. № 34. P. 10594.
18. Гуляев Ю.В., Черепенин В.А., Таранов И.В. и др. // Журнал радиоэлектроники [электронный журнал]. 2014. №11, URL: http://jre.cplire.ru/jre/nov14/9/text.pdf
19. Schoenbach K.H., Beebe S. J., Buescher E. S. // Bioelectromagnetics. 2001, V. 22. № 6. P. 440.
20. Ландау Л.Д. , Лифшиц Е.М. Электродинамика сплошных сред. М.: Физматлит, 2003.
21. Yu.V. Gulyaev, V.A. Cherepenin, V.A. Vdovin, I.V. Taranov, A.A. Yaroslavov, V.P. Kim, and G.B. Khomutov // Journal of Communications Technology and Electronics, 2015, Vol. 60, No. 10, pp. 1097–1108.
22. V.P. Kim, A.V. Ermakov, E.G. Glukhovskoy, A.A. Rakhnyanskaya, Yu.V. Gulyaev, V.A. Cherepenin, I.V. Taranov, P.A. Kormakova, K.V. Potapenkov, N.N. Usmanov, A.M. Saletsky, Yu.A. Koksharov, and G.B. Khomutov //Nanotechnologies in Russia, 2014, Vol. 9, N. 5–6, p. 280–287.