МАГНИТНО-РЕЗОНАНСНАЯ ТЕРМОМЕТРИЯ ГОЛОВНОГО МОЗГА КРЫС МЕТОДОМ ЛОКАЛЬНОЙ ЯМР СПЕКТРОСКОПИИ
М. В. Гуляев1, С. К. Ханов1, Д. Д. Наместникова2, Л. В. Губский2, Чжоу Фушан3, Ю. А. Пирогов1, В. Я. Панченко1
1 Московский государственный университет имени М.В.Ломоносова
2 Российский национальный исследовательский медицинский университет имени Н.И.Пирогова
3 Национальный университет Тайваня
Статья получена 16 октября 2013 г.
Аннотация. Разработан неинвазивный метод измерения температуры головного мозга крыс в области искусственно созданной ишемии на основе данных ЯМР-спектроскопии с МРТ локализацией исследуемого воксела. В качестве референтных значений для таких измерений выбраны метаболиты NAA (N-ацетиласпартат), Cho (холин), Cr (креатин), отражающие степень жизнедеятельности тканей головного мозга. Эксперименты in vivo на лабораторных животных в режиме локальной 1H ЯМР-спектроскопии показали, что на основе измерений химического сдвига спектральных линий можно по амплитудно-частотному ЯМР спектру определять как метаболический портрет, так и температуру интересующей ткани. Таким образом, протонная ЯМР-спектроскопия в сочетании с МРТ локализацией измеряемого воксела (локальная ЯМР-спектроскопия) служит эффективным способом неинвазивного in vivo измерения температуры тканей головного мозга и определения степени их ишемизации.
Ключевые слова: магнитно-резонансная термометрия, локальная ЯМР-спектроскопия, ишемия головного мозга, метаболиты, магнитно-резонансная томография.
Abstract. It is developed a method measuring temperature of internal tissues in the area of artificially created cerebral ischemia for rats by NMR-spectroscopy. NAA (N-acetylaspartate), Cho (choline), Cr (creatine) metabolites were selected as reference values for these measurements. In vivo experiments on laboratory animals with local 1H NMR spectroscopy showed that based on the measurement of the chemical shift of the spectral lines by using the amplitude-frequency NMR spectrum one can define a metabolic portrait and the temperature of interesting tissue. So the proton NMR spectroscopy in combination with MRI localization of measured voxel (local NMR spectroscopy) can serve as an effective way of non-invasive in vivo measuring the brain tissues temperature and determination of ischemia extent.
Key words: magnetic resonance thermometry, local NMR spectroscopy, cerebral ischemia, metabolites, magnetic resonance imaging.
1. Введение
Температура тканей головного мозга зависит от различных механизмов терморегуляции, экзо- и эндотермических биохимических процессов. Эти факторы могут существенно изменяться при различных патологиях (например, при ишемии) и приводить к изменению температуры ткани.
Температуру внутренних тканей организма обычно оценивают либо неинвазивным способом на поверхности тела с помощью термометра, располагая его как можно ближе к зоне интереса, либо инвазивно – с проколом термозондов в измеряемую область. Однако, оба этих способа несовершенны: неинвазивные измерения могут, в лучшем случае, служить лишь для приблизительной оценки температуры, а термозондовые методы часто клинически неприемлемы, т.к. приводят к повреждению живой ткани и совершенно не годятся при исследовании головного мозга.
Альтернативный подход заключается в использовании в качестве температурного зонда имеющегося в исследуемой ткани эндогенного вещества, стабильного относительно большинства физиологических факторов и имеющего химический сдвиг ЯМР спектральных линий, не зависящий от температуры. Для ЯМР-спектроскопии такими веществами выступают основные метаболиты головного мозга, которые содержатся в достаточном для регистрации эффекта количестве.
Большой круг ЯМР исследований основан на измерении смещений резонансной частоты протонов 1Н, в частности, протонов воды, при повышении температуры. Это происходит, в основном, за счет изменения константы экранирования в результате разрыва, растяжения или изгиба водородных связей [1]. В результате имеет место линейная зависимость химического сдвига спектральной линии воды от температуры, по крайней мере, до 80°С. Достоинством такой методики является постоянство температурного коэффициента этой зависимости для большинства типичных тканей, что продемонстрировано на модельных объектах и тканях различных типов in vivo и ex vivo [2,3].
На практике ситуация осложняется тем, что химический сдвиг определяется не только локальным магнитным полем, но и магнитной восприимчивостью образца, которая в свою очередь, зависит от температуры. Дополнительными причинами, приводящими к погрешностям измерения температуры в тканях, являются: низкое отношение сигнал/шум, ограниченное спектральное разрешение, неоднородность магнитного поля и поля вихревых токов, дрейф поля, изменение перфузии и содержания кислорода в крови. Изменение положения, размера или геометрии объекта (например, мышцы) могут также приводить к значительной погрешности измерения температуры. К недостаткам метода относят в итоге невысокое пространственное и температурное разрешение.
Тем не менее, линейная зависимость параметров ЯМР от температуры позволяет перенести опыт модельных экспериментов на живые системы для неинвазивного измерения температуры внутренних органов (в настоящей статье – ишемизированных тканей головного мозга крыс). В работе сравнивались спектры метаболитов N-ацетиласпартата NAA, холина Cho и креатина Cr в области ишемии и здоровой ткани головного мозга крыс.
2. Постановка эксперимента и метод локальной ЯМР спектроскопии
Эксперименты по локальной ЯМР-спектроскопии проводились в Центре магнитной томографии и спектроскопии МГУ имени М.В.Ломоносова на магнитно-резонансном биоспектротомографе BioSpec 70/30 фирмы Bruker с постоянным магнитным полем 7 Тл и резонансной частотой 300,3 МГц. Биоспектротомограф оснащен импортным программным обеспечением: ParaVision v.5.0 для обработки МРТ-изображений и TopSpin v.2.0 для обработки спектральных данных.
В качестве лабораторных животных использовались половозрелые крысы-самцы Wistar. Животных содержали в стандартных условиях вивария при естественном освещении и свободном доступе к воде и пище. Исследования проводили в соответствии с правилами, принятыми Европейской конвенцией по защите животных, используемых для экспериментальных целей.
Для обездвиживания крыс во время эксперимента применялась газовая смесь изофлуран (Isoflurane), подводимая с помощью специального оборудования к голове животного. К платформе, на которой располагалось животное, по трубкам подавалась подогретая вода для предотвращения переохлаждения и поддержания постоянной температуры тела крысы внутри томографа.
Локальная ишемия головного мозга вызывалась путем окклюзии правой средней мозговой артерии (СМА) с помощью нейлонового микрофиламента. Спустя 60 минут филамент удаляли и проводили МРТ сканирование с определением локализации области ишемии, из которой получали локальные 1H ЯМР спектры.
Температура тела животного регистрировалась в течение всего эксперимента ректальным МРТ-совместимым термодатчиком, как показано на Рис.1.
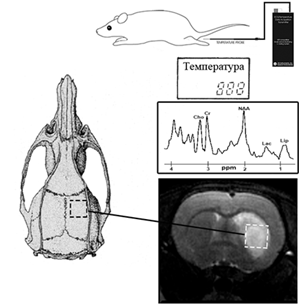
Рис. 1. Схема МР-термометрических экспериментов на крысах: внутренняя температура тела регистрировалась ректальным термодатчиком, спектры измерялись в подкорковой области головного мозга (на рисунке выделена штриховой линией).
3. Результаты измерений
В ходе эксперимента были получены температурные данные для метаболитов головного мозга крыс в ишемической области, измеренные методом локальной 1Н ЯМР-спектроскопии. Информация о локализации очага ишемии определялась по Т2-взвешенным изображениям (Т2ВИ) – Рис.2. Для этого использовалась импульсная последовательность (ИП) RARE.
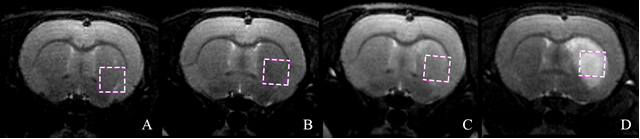
Рис. 2. T2ВИ мозга крысы. А: перед операцией; B: с окклюзией CMA;
C: сразу после извлечения филамента; D: спустя 24 часа после возникновения ишемии.
Пунктиром
ограничено сечение куба, внутри которого регистрировался сигнал 1H ЯМР.
Для получения in vivo локальных 1H ЯМР спектров использовалась ИП PRESS (Point Resolved Spectroscopy). В этой ИП синхронно с РЧ импульсами применяются градиентные поля, приводящие к эффективному уменьшению объема области, на которую воздействуют РЧ импульсы.
В настоящей работе локальные 1H ЯМР спектры регистрировались из области в форме куба с размером ребра 2,6 мм – Рис. 2. Такой объем соизмерим с объемом ишемически пораженной части головного мозга, обеспечивая спектральные измерения с максимальным отношением сигнал/шум для составляющих метаболитов тканей.
ЯМР эксперименты проводились в три этапа: снимались локальные 1H ЯМР спектры головного мозга крысы и температурные показатели ректального термодатчика 1) до операции (норма), 2) во время окклюзии CMA (ишемия), 3) сразу после извлечения филамента (реперфузия).
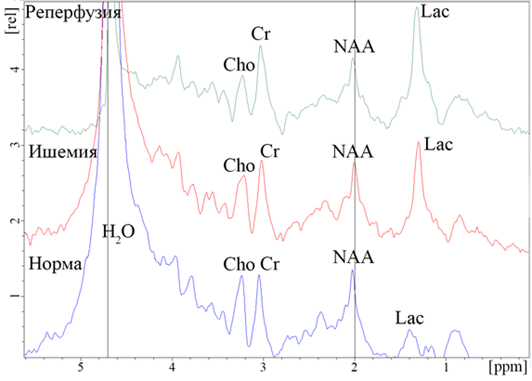
Рис. 3. Локальные 1H ЯМР спектры головного мозга крысы: до операции (норма), во время окклюзии CMA (ишемия), сразу после извлечения филамента (реперфузия). Максимум спектральной линии воды соответствует
значению 4,7 ppm.
В локальном 1H ЯМР спектре до проведения операции по окклюзии СМА наиболее отчетливо определялись следующие метаболиты: N-ацетиласпартат (NAA), холин (Cho), креатин (Cr), лактат (Lac), липиды (Lip) – Рис. 3. Относительное соотношение пиков данных метаболитов в спектре дает основание считать мозг крысы здоровым (Рис. 3 – норма).
Как видно из Рис. 3, в остром периоде ишемии отмечается существенное увеличение Lac, относительно постоянное содержание NAA и Cho, уменьшение Cr, а также значительное увеличение отношения Lac/Cr в зоне ядра инсульта.
На основе результатов экспериментов с модельными средами, содержащими выбранные метаболиты (NAA, Cr, Cho), были получены эмпирические формулы для вычисления температуры в зоне интереса [4,7,8].
Зависимость температуры T в зоне интереса от химического сдвига δ пары «вода – метаболит» выражается с помощью следующего линейного уравнения:
T = T0 + α × (δ(вода – метаболит) – δ0),
где T – температура в °C; T0 – нормальная температура в зоне интереса, в нашем эксперименте равна 36 °C в головном мозге крысы [5,6]; α – коэффициент корреляции, определяемый эмпирически для каждого метаболита; δ0 – разность химических сдвигов «вода – метаболит» при нормальной температуре в зоне интереса. Данные, полученные на основе модельных экспериментов, представлены в Табл. 1:
|
Метаболит |
α, °C/ppm |
δ (вода – метаболит) при 36 °C, ppm |
Эмпирическая формула для расчета температуры в °C |
|
NAA |
- 103,80 ± 1,90 |
2,676 ± 0,001 |
T = 313,77 – (103,80 * δH2O-NAA) |
|
Cr |
- 101,70 ± 1,72 |
1,659 ± 0,001 |
T = 204,72 – (101,70 * δH2O-Cr) |
|
Cho |
- 106,08 ± 2,07 |
1,476 ± 0,001 |
T = 192,57 – (106,08 * δH2O-Cho) |
Табл. 1. Сводная таблица результатов модельных экспериментов на фантомах.
Эмпирические формулы для расчета температуры в зоне интереса были проверены в эксперименте по созданию локальной ишемии в головном мозге крыс. Результат измерения температуры, определяемой исходя из вариаций химического сдвига спектральной линии метаболита NAA, представлен на Рис. 4.
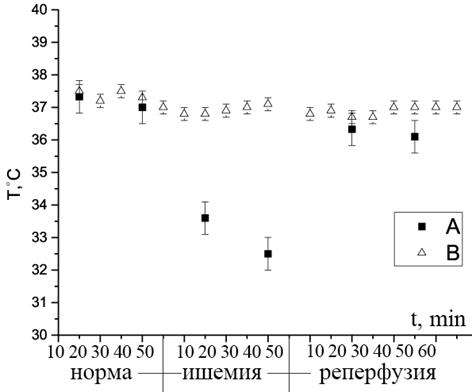
Рис. 4. График изменения температуры в зоне ишемии на протяжении эксперимента. Точки А – температура в зоне ишемии, рассчитанная по формуле для NAA, точки В – температурные показания ректального термодатчика.
Отметим, что кривые на этом рисунке хорошо согласуются с литературными данными инвазивных (термозондовых) измерений [5,6]: в зоне ишемии температура может опускаться до 32,5 ± 0,5 °C. Сразу после удаления филамента, перекрывающего сосуд, температура восстанавливается за счет частичного или полного восстановления кровотока, что подтверждается и расчетами на основе ЯМР спектров.
4. Выводы
По результатам работы можно сделать вывод о возможности мониторинга тепловых полей непосредственно в процессе МРТ-исследований. Несмотря на большое количество ограничений, представляется возможной корректная регистрация реальной температуры внутри биоорганических сред методами МР-термометрии.
Главную трудность для МР-мониторинга температуры, как выяснилось, составляет не столько аппаратная часть, сколько условия реальной медицинской практики – неоднородность тканей, перфузия на кровеносных сосудах, нестабильность теплового поля. Построение калибровочных кривых позволяет в ряде случаев прогнозировать температуру в зоне интереса и получать информацию не только об относительном изменении температуры, но и корректно измерять абсолютное ее значение.
Эксперименты in vivo на лабораторных животных в режиме локальной 1H ЯМР-спектроскопии показали, что метод на основе химического сдвига позволяет по амплитудно-частотному локальному 1H ЯМР спектру (химсдвигу и соотношению спектральных линий) определять как метаболический портрет, так и температуру интересующей ткани.
Локальная 1H ЯМР-спектроскопия в сочетании с МРТ может служить эффективным способом неинвазивного in vivo определения температуры метаболитов при ишемии головного мозга. Для последующих исследований представляет особый интерес информация о локальных 1H ЯМР спектрах и в других внутренних органах, а также ЯМР-спектроскопия на ядрах, отличных от протонов.
Работа выполнена при поддержке российско-тайваньского гранта РФФИ №11-04-92008-ННС_а.
1. Marshall, B. Karaszewski, J.M. Wardlaw, et. al., Measurement of regional brain temperature using proton spectroscopic imaging: validation and application to acute ischemic stroke, Magn Reson Imaging 2006, 24, 699 – 706.
2. K. Kuroda, R.V. Mulkern, K. Oshio, et. al., Temperature mapping using the water proton chemical shift: self-referenced method with echo-planar spectroscopic imaging, Magn. Reson. Med. 2000, 43, 220–225.
3. K. Kuroda, Non-invasive MR thermography using the water proton chemical shift, Int J Hyperthermia 2005, 21, 547–560.
4. E.B. Cady, P.C. D'Souza, J. Penrice, A. Lorek, The estimation of local brain temperature by in vivo 1H magnetic resonance spectroscopy, Magnetic resonance in medicine / Society of Magnetic Resonance in Medicine. 1995 33(6): 862-7.
5. Ansgar M. Brambrink, Laszlo Kopacz, Andreas Astheimer, Holger Noga, Axel Heimann, Oliver Kempski, Control of brain temperature during experimental global ischemia in rats, Journal of Neuroscience Methods 92 (1999) 111–122.
6. Hiroaki Minamisawa, Pekka Mellergard, Maj-Iis Smith, Finn Bengtsson, Sten Theander, Fredrik Boris-Moller and Bo K. Siesjo, Preservation of Brain Temperature During Ischemia in Rats, Stroke. 1990;21:758-764
7. M. Zhu, A. Bashir, J.J. Ackerman, D.A. Yablonskiy, Improved Calibration Technique for In Vivo Proton MRS Thermometry for Brain Temperature Measurement, Magnetic Resonance in Medicine 60: 536–541 (2008).
8. Анисимов Н.В., Батова С.С., Пирогов Ю.А. Магнитно-резонансная томография: управление контрастом и междисциплинарные приложения / Под ред. проф. Ю.А.Пирогова.- М.: МАКС Пресс, 2013, 244 с.