ЭЛЕМЕНТАРНЫЕ МОРФОМЕТРИЧЕСКИЕ ЛАБОРАТОРИИ НА ЧИПЕ НА ОСНОВЕ ГЕМОЦИТОМЕТРИЧЕСКИХ КАМЕР с РАДИОЧАСТОТНОЙ ИДЕНТИФИКАЦИЕЙ культур и ТРАНСЛЯЦИЕЙ СПЕКТРОЗОНАЛЬНО-гистохимического МОНИТОРИНГА
А. В. Нотченко 1,2, О. В. Градов 1,3
1Лаборатория нейронной структуры мозга НЦН РАМН
2МГТУ им. Баумана; 3Институт химической физики РАН
Получена 20 января 2012 г.
Аннотация. Предложена общедоступная конструкция автономных (не требующих специального устройства для считывания) лабораторий на чипе с использованием для секционирования детектируемых клеток, выделяемых с помощью аппарата Сайка, сетчатых счетных камер гемоцитометрического типа. Предложена система их автоматизированной радиочастотной идентификации в условиях длительного хранения, сопровождающейся получением новых морфометрических данных на различных стадиях культивирования или биомониторинга. Описана дифракционная методика подсчета и фингерпринтинга клеточных образований в варьируемых условиях среды. Приведены экспериментальные данные по апробированию для её реализации камер Фукса-Розенталя, Бюркера, Нейбауэра, Маклера и Тома-Цейсса. Показана применимость данных устройств в когерентно-денситометрической индикации концентрационной динамики в клеточной культуре или суспензии и морфогенетических процессов в них для ламинарных условий среды. Продемонстрирована самообучающаяся программа для распознавания паттернов клеток и прецизионной цитоморфометрии на базе лаборатории на чипе с объектно-микрометрической калибровкой по сетке камеры. Введен в практику гибридный in vitro / in silico принцип мониторинга морфогенеза культур.
Ключевые слова: лаборатория на чипе, телемедицина, ПЗС, радиочастотная идентификация, спектрозональный мониторинг, математическая морфология, автоматическое распознавание и классификация образов, КМОП, гистохимия
Abstract. An accessible design of autonomous labs on the chip which do not require a special reader is developed. The proposed device uses hemocytometric counting chambers for determination of concentration of cells, isolated by a special device for cell sedimentation. A system of automated RF-identification of chambers in the long-term storage is proposed which provides new morphometric data at various stages of cultivation or biomonitoring. A new diffraction method of calculation and fingerprinting of cellular structures in varying environmental conditions is described. Experimental data on the pilot testing of Fuchs-Rosenthal, Buerker, Neubauer, Makler and Thoma chambers for the described technique is given. The applicability of these devices for coherent-densitometric indication either of concentration dynamics in cell culture or suspension or morphogenetic processes in them for laminar conditions is shown. A self-learning program for cellular pattern recognition and relational cytophotometry based on lab on the chip with an object-micrometric calibration relative to the counting net is demonstrated. A hybrid in vitro / in silico method of morphogenesis monitoring in cell cultures is introduced.
Keywords: lab-on-a-chip, telemedicine, CCD, CMOS, RFID, mathematical morphology, spectrozonal mapping, machine learning, machine vision, pattern recognition, automatic classification, hystochemistry.
Введение
В настоящее время в биомедицинской практике цивилизованных стран широко используются технологии Lab-on Chip или иначе – «лаборатории на чипе» [1]. Помимо биохимической микрофлюидики, одними из основных направлений использования лабораторий на чипе являются культивация клеток [2-5] и микроскопический мониторинг метаболомики организмов [5-8]. Трендом культивации клеток на чипах является создание нейронных сетей in vitro на базе культур нервной ткани [9-11] и их комплексный анализ, включающий в себя биохимические и электрофизиологические измерения на чипе [12-16]. Одним из способов регистрации цитохимических и гистохимических параметров в чипах является применение многоэлементных фоточувствительных матриц на базе приборов с зарядовой связью или их аналогов (в частности, КМОП) [17-22]. Микрофотометрические и флуориметрические методы применяются в лабораториях на чипе наряду с электрическим (биоэлектрохимическим) детектированием, что обеспечивает высокую эвристическую ценность результатов использования подобных технологий [23]. Так как вышеуказанные детекторы позволяют регистрировать сигнал на большой площади с высоким пространственным разрешением, возможно совмещение биохимических и кинетических измерений с морфометрией цитологических и гистологических структур в жидкой фазе.
Конструкция элементарной лаборатории на чипе состоит из детектирующей матрицы и микронных бороздок для реализуемой на чипе микрофлюидики (капилляров для капиллярного электрофореза, лунок для иммунологических исследований, бороздок для культивации клеток и т.д.) и может быть легко воспроизведена в лабораторных условиях. Для конкретных применений оптимизированы различные топологии чипов и микрофлюидики. Вместе с тем, в силу узкой специализации топологий, следующего из неё малосерийного или штучного изготовления соответствующих образцов лабораторий на чипе, имеющих в результате высокую стоимость, рутинное повседневное применение лабораторий на чипе является, скорее, экзотикой, чем правилом, вытекающим из задач цитоморфологических и гистоморфологических коллективов. Для преодоления отставания лабораторной практики постсоветской морфологии от трендового методического направления зарубежной науки предлагается упрощенная версия лаборатории на чипе со сменным типом микробороздок, базирующаяся на применении счетных камер и пригодная для компьютерного цифрового анализа данных без использования дополнительных считывающих устройств.
Конструкция лаборатории на чипе
Нами предлагается следующая конструкция лаборатории на чипе. В качестве регистрирующего устройства используется ПЗС или КМОП матрица без теплового ИК фильтра (последнее обстоятельство даёт возможность использовать в дальнейшем лабораторию на чипе также как микротепловизор - термовизиограф[1]). В качестве разделяющих бороздок для рутинных клеточных измерений предлагается использовать стандартные камеры с сетками Фукса-Розенталя, Бюркера, Нейбауэра или Тома-Цейса[2]. Для этого следует располагать их штриховкой вниз над поверхностью ПЗС-матрицы так, чтобы жидкая среда соприкасалась с матрицей (что даёт возможность использовать иммерсионные методы). Расположение камер сеткой над матрицей или матрицей над сеткой определяется типом микроскопии замещаемого лабораторией на чипе метода, аналогично различию между прямым и инверсным микроскопами. Если не использовать антиалиасную фильтрацию на матрице, убрав соответствующий фильтр, то возможно будет получать с помощью данной лаборатории на чипе муарограммы микроструктур. В зависимости от исследовательских потребностей, можно использовать различные ПЗС-системы. Для мультиспектральных и спектрозональных исследований, очевидно, нужны различные матрицы; цейтраферные и сверхвысокоскоростные режимы регистрации требуют различной электронной "начинки", поэтому также не могут быть эффективно совмещены по времени экспозиции. Следует отметить зависимость скорости регистрации от объёма данных, то есть - от разрешения матрицы. Так как физический размер отдельных пикселей матрицы (0,005-0,006 мм) меньше стороны малого квадрата счетных камер (0,05-0,25 мм), удельное количество пикселей на квадрат счетной камеры достаточно для регистрации разрешающего на клеточном уровне видеосигнала. Нами рекомендуется использование высокоразрешающих матриц крупного формата, покрывающих решетку гемоцитометра целиком или в значительной степени. В идеальном случае, логично использовать детекторы форматов типа APS-H (28,1×18,7 мм) или APS-C (20,7×13,8 мм - 25,1×16,7 мм). Разрешение современных APS-H доходит до 120 мегапикселей (13280×9184). Возможность использования таких матриц в НИР определяется параметрами вычислительной техники для обработки данных, так как, для примера, 200-мегапиксельная регистрация Hasselblad H4D-200MS даёт файлы 2D-изображений размером ≈ 600 Мб с весьма высоким машинным временем математической обработки. Однако, поскольку речь в настоящей статье пойдёт об универсальной системе общедоступной для сборки в условиях лабораторий с низким бюджетом, возможности их использования здесь не описываются.
Материалы и методы
Нами были использованы демонтированные монохромные модульные камеры типа SK-1004CMAI/SO (Sunkwang) и ACE-S360CM (KT&C), подключавшиеся через профессиональную внешнюю плату АЦП и не регистрировавшие данные об экстинкции в спектрозональном режиме, а также цветные (с фильтрацией по Байеру) цифровые матрицы камер ST-Lab, Microlab и U.S.Robotics с собственной электроникой и интерфейсом USB. Последние были отъюстированы по методике ФИАН [24] и продемонстрировали однотипные параметры чувствительности в спектрозональных каналах.
Конструкция элементарной цитологической лаборатории на чипе, воспроизводимая в лабораторных условиях, приведена на Рис.1. Она состоит из ПЗС-матрицы с фильтрами Байера и микролинзами, счетной камеры одного из указанных типов, системы цифровой обработки изображения (АЦП) со схемой компрессии и интерфейса, выводящего сигнал на компьютер. Обработка сигнала производилась с помощью программного обеспечения, обеспечивавшего фотометрию и флуориметрию в избранных точках образца, изолинейное картирование оптической плотности (построение изофот), построение профилей люминанса при флуоресцентном окрашивании, морфометрию и угловые измерения отдельных областей, спектрозональные измерения концентраций цветных витальных красителей, 3D реконструкцию межфазной границы и корреляционно-спектральный анализ интерфейса «детектор – жидкая среда».
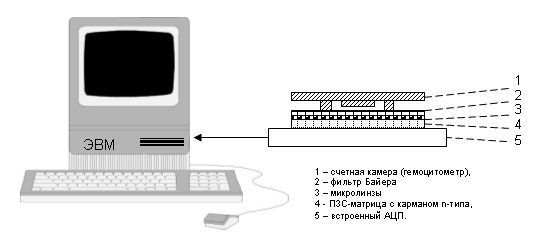
Рис.1. Упрощенная схема элементарной компьютеризованной лаборатории на чипе.
Также, с целью микроминиатюризации «лабораторий на чипе», были апробированы варианты радиопередающих «чипов», аналоговый сигнал которых принимался ресивером ENC (частота 1,2 / 2,4 ГГц, передатчики PK-B81W, WS-007AS, ES-8007, NW-1207AS). Для цифровой регистрации использовался четырёхканальный блок-ресивер системы P-817GA (или ZT-901GA) с диапазоном перестройки 2,4-2,483 ГГц, транслировавший данные на ПК через интерфейс USB. Это позволило избавить конструкцию от лишних проводников.
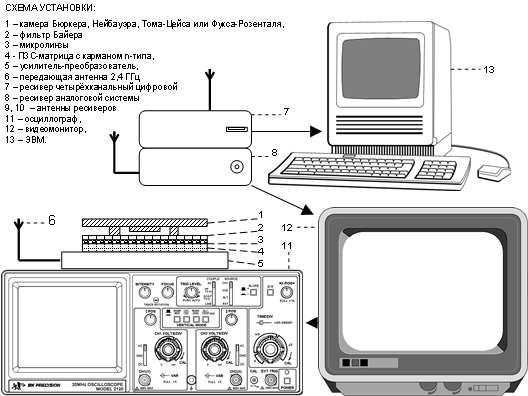
Рис. 2. Схема установки для регистрации сигнала радиочастотных лабораторий на чипе.
Схема лабораторной исследовательской установки на базе чипа с радиочастотной трансляцией приведена на Рис.2. Выходной сигнал печатной платы с матрицей поступает по радиоволновому каналу с передающей антенны на приемные антенны ресиверов, расположенных на дистанции до 50 м от источника сигнала и выводится через переходник стандарта BNC на видеомонитор JVC, а также через универсальную серийную шину на ЭВМ. При этом видеосигнал от монитора разветвляется на осциллограф Tektronix 1740 или любой функциональный аналог, позволяющий исследовать микрогидродинамику на чипе и, следовательно, в культуре, по изменениям формы волны компонентного сигнала. Регистрировавшийся сигнал использовался одновременно и как источник информации о состоянии исследуемой субстанции (в частности, допустимы денситометрия по уровню сигнала и спектральный анализ сигнала с целью установления распределения структур по размерам / дисперсности), и как аналог RFID - идентификации данного чипа (см. ниже).
В качестве направляющих каналов использовались счетные камеры «Arial Bürker», «Neubauer-improved», «Thoma-new» и стандартные версии фирмы Hirschmann Laborgerate. Тестировавшиеся камеры Маклера фирмы Sefi Medical Instruments показали негативные результаты при использовании в системе с чипом и поэтому в работе не использовались.
В качестве тестовых объектов использовались диссоциированные культуры тканей и модельные дисперсные системы (суспензии), а также морфогенетические биомиметики с их использованием.
В случае дистанционной трансляции сигнала лабораторий на чипе ПЗС запитывались от 9В батарей типоразмера 48,5 мм × 26,5 мм × 17,5 мм (625 мА·ч) и могли храниться в термостатируемых условиях или в климатической камере в беспроводном состоянии, при этом передавая сигнал на частоте, "пеленгуемой" ресивером. В итоге расположение чипов в любом из боксов хранения можно было с достаточной точностью обнаружить по форме сигнала источника, не используя поиск вручную или по картотеке. В аналогичном режиме можно было вести длительный мониторинг состояния структур в лаборатории на чипе при регистрации с заданным промежутком времени изменений формы и параметров сигнала. За счет применения различных камер - источников ПЗС можно было регистрировать их сигналы с помощью единого ресивера последовательно в известном (см. выше) диапазоне частот, что обеспечивало быстрое переключение от передатчика к передатчику. Помимо того, сигнал мог быть детектирован множеством ресиверов и, как следствие, измерен или визуализирован с помощью множества коммутированных с ними функционально разных измерительных устройств, характеризующих различные параметры изучаемой структуры и её морфобиохимической динамики.
Применяемые для этого устройства могут быть вполне заменены виртуальными USB - коммутируемыми агрегатами ("лабораториями"), содержащими в себе все необходимое для многопараметрического измерения сигналов подобных лабораторий на чипе.
Тестирование системы
Тестирование лаборатории производилось в несколько этапов по ряду параметров:
Денситометрический тест. Оценивалось соотношение сигнал / шум. Юстировалась регистрирующая часть по методике [24]. Оценивался контраст отображения. С помощью колориметрии определялась интенсивность сигнала в спектрозональных областях (тогда и только тогда, когда сигнал снимался с использованием фильтров Байера). Аналитическим путём - сравнением с образцами с известной экстинкцией калибровалась кривая отклика[3].
Резольвометрический тест. Сличались результаты сканирования прогрессивной и построчной разверткой поверхностей гемоцитометра и (в качестве контроля) кварцевого предметного стекла с нанесенными на них дисперсиями. Были промерены образцы разной оптической плотности и удельной концентрации частиц, показавшие пределы регистрации микрообъектов лабораториями на чипе с различными разрешениями ПЗС. На Рис. 3 (а, б) приведены примеры построчного сканирования чипа и кварцевого стекла с суспензиями дисперсных частиц, размерно-моделирующих клеточные структуры, разрешаемые чипом. Используя камеру как эталон, эквивалентный объект-микрометру, можно отъюстировать лабораторию на чипе для размерных измерений. Для этого используется преобразование обычного выражения для измерения увеличения микроскопа по счетной камере: приняв, в силу взаимно однозначного соответствия накладываемых друг на друга лаборатории на чипе и детектора, увеличение равным единице, (x1 - x2) / r * N = 1, где x1, x2 - положения границ клеток камеры, N - количество клеток между измеряемыми границами, r - размер клетки камеры, получим (x1 - x2) = r * N или r = N / (x1 - x2). Эта процедура выполняется с помощью ЭВМ, управляющей установкой лаборатории на чипе (см. ниже).


Рис. 3. Построчное сканирование чипа (а) и кварцевого стекла (б).
"Градиентометрический" тест. В строгом смысле, поиск границ при картировании градиента, осуществляемый с использованием точек юстировки по линиям. Рефлексы на границах клеток счетной камеры могут являться критерием правильности её установки на детектирующем чипе: если на автоматически распознаваемой градиентной границе потока (фронта) частиц имеют место точки, лежащие на осях координат или на параллельных им линиях юстировочной сетки графика, коррелирующей с расположением сетки камеры, то камера установлена верно и анализ распространения и картирование градиента корректны для данного положения лаборатории на чипе. В качестве угловой юстировки по жидкости можно также применять ватерпасный эффект (образование пузырька и жидко-газофазной границы в бороздках лаборатории на чипе). На Рис. 4 приведены примеры картирования градиента с автоматическим поточечным распознаванием границ. Можно видеть, что чип с бороздками счетной камеры (а) обнаруживает наличие точек на оси абсцисс и прямых, ортогональных драг другу в районе 481 у.е. по ординате F (от "Front") и 1.682 по абсциссе, в то время как для предметного стекла характерна неупорядоченная динамика с полным отсутствием эффектов гидирования биогидродинамического потока. Вместе с тем, углы между осью абсцисс и трендом, аппроксимирующим фронт распространяющегося потока, для лаборатории на чипе и для детектирования микрофлюидики на поверхности пластины (кварцевого стекла) с помощью той же матрицы различны, что говорит о преимуществах разработанной лаборатории на чипе по регулярности и упорядоченности распространения анализируемого потока перед стандартными технологиями подсчета клеток на планарных подложках.
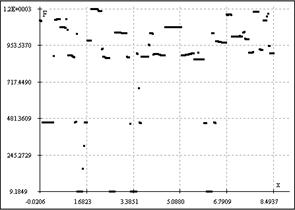
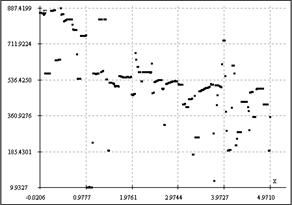
а б
Рис. 4. Визуализация градиентной границы плохо смешивающихся биохимических фаз на поверхности чипа (а) и предметного стекла (б).
Микрогидродинамический (микрофлюидный) тест. С помощью осциллографии или мониторинга формы волны, доступного в виде цифровой эмуляции в Adobe Premier или в аналоговом виде с помощью аппаратного Waveform Monitor'a, можно характеризовать по оптической плотности распространяющейся волны микрогидродинамические изменения, происходящие в среде, и реконструировать передвижение клеток в ходе морфогенеза. В последнем случае целесообразно, используя GFP или аналогичные флуорохромы, строить спектрозональную карту их распределения с помощью осциллографии соответствующего канала монитора или (в случае монохромной регистрации) изучать параметры светимости подсчитываемых объектов (Luma). На Рис. 5 приведен пример микрогидродинамического теста монохромной лаборатории на чипе с помощью Waveform Monitor'a: можно видеть, что визуализируемый профиль волны не имеет, судя по векторограмме, спектрозональной хроматической составляющей (соответствующих векторов в цветовом пространстве нет).
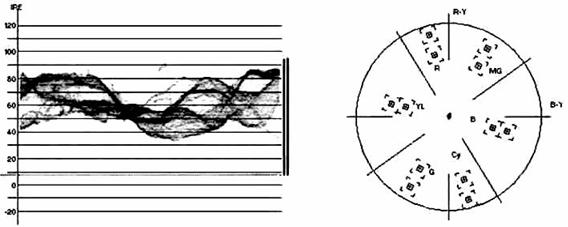
Рис. 5. Осциллограмма и векторограмма, снятые с матрицы лаборатории на чипе.
Центровка счетной камеры
Использование светочувствительных детекторов типа КМОП, ПЗС предусматривает использование облучения или собственной флуоресценции для регистрации объектов. Для этого необходимо наличие высокоинтенсивных источников для проекции форм клеток на чип (с поверхности, несколько удаленной от него в силу конструкции счетных камер) или возбуждения флуоресценции окрашенных клеток. В таком случае этот источник может и должен быть использован для центровки камеры относительно регистрирующей матрицы. Рассмотрим случай с наиболее точным позиционированием с помощью лазерного модуля. Исходно на поверхность чипа проецируется когерентный пучок, рассеивающийся на сетке камеры за счет дифракции. Так как у камеры центральная часть обладает наивысшей для данной решетки плотностью линий, рассеяние там идёт наиболее эффективно. Рассеяние пучка на неоднородностях диффузной поверхности приводит к образованию текстурных спеклов. В результате, центр максимума распределения гауссова пучка должен совпадать с центром решетки. Пример юстировки положения счетной камеры на матрице методом профилирования пучка приведен на Рис. 6.
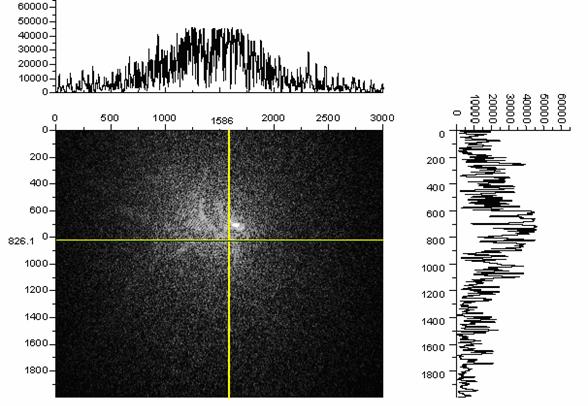
Рис. 6. Центрирование счетной камеры к ПЗС по экстремуму максимума гауссова пучка. Цифры 1568 и 826.1 по осям - координаты положения курсора на пересечении линий.
В случае отсутствия лазерных модулей данную процедуру можно произвести с помощью микропучкового ультрафиолетового источника, часто имеющегося в морфологических лабораториях, владеющих ультрафиолетовой или микропучковой флуоресцентной микроскопией. В отличие от регистрации лабораторией на чипе клеток в стандартном режиме, центровка требует применения линзы или простого объектива для получения спекл-пучка.
Используя лазерную систему для центровки, можно использовать этот же источник при позиционно-чувствительной регистрации. Так как в каждой из лунок счетной камеры можно локализовать регистрируемый флуоресцентный аналит или субпопуляцию клеток, взаимодействие лазерного пучка с каждой из гемоцитометрических ячеек может являться достаточно специфичным для идентификации. Так как каждой квадратной ячейке можно сопоставить определённое усредненное значение оптической плотности или светимости, при лазерно-дифракционном типе регистрации можно ограничить дискретизацию камеры, сопоставив каждой ячейке гемоцитометра один пиксель с усредненным по пропусканию значением на грубо дискретной карте градиента. Аналогичная процедура применяется в автоматизированном секвенировании с электрофоретической сепарацией. В таком случае преломление и отражение пучка от клеток будет являться идентификацией их наличия с данными параметрами в пункте, соответствующем данному пикселю. На Рис. 7 приведен пример идентификации небольшого рефрагирующего скопления клеток на поверхности счетной камеры с произведенным в программном пакете Origin слиянием пикселей [4].
Этот тип морфологической визуализации характерен тем, что позволяет картировать клетки в культуре не по их собственной оптической плотности, а по другим оптическим свойствам пучка на выходе из препарата (в частности, при определенных доработках, связанных с внедрением поляризационного светофильтра в систему, можно картировать оптическое вращение, замещая тем самым поляризационную микроскопию для лабораторий на чипе; аналогично, введением поляризующих элементов, можно воспроизвести методы круговой поляризации флуоресценции / кругового дихроизма, насколько это позволяет техника для денситометрических и спектрозональных, а не спектральных измерений в микроскопии и замещающих её методах, каковым является принцип лабораторий на чипе).
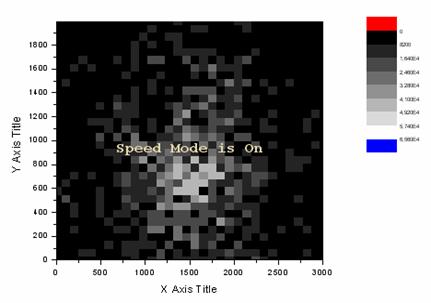
Рис. 7. 10-разрядная карта градиента с интегрированными пикселями.
Использование лабоатории на чипе для наблюдения морфогенеза
Проецируя излучение на детектор в системе, обладающей активной гидродинамикой, мы, по существу, воспроизводим метод лазерной допплеровской велосиметрии (LDV) или флоуметрии (LDF), активно используемый в современных биомедицинских изысканиях, в варианте лаборатории на чипе. Как следствие, возникает возможность исследования, при интерпретации наблюдаемых в лаборатории на чипе явлений, принципов морфодинамики (или, что правильнее, морфо - гидродинамики) пролиферирующих культур на чипе.
Это, в свою очередь, даёт возможность моделирования морфогенеза с помощью лабораторий на чипе с визуализацией реальных "морфогенетических полей" и "градиентов"[5], образуемых физическими агентами, визуализируемыми методами построения векторных полей и карт градиента путём цифровой обработки сигнала, поступающего с лаборатории на чипе. Это можно пояснить на элементарном примере.
Таблица 1: Формирование складки в культуральной модели эмбрионального морфогенеза. Визуализация: изолинейное картирование градиента (теневой гидродинамический метод) и построение векторов оптического потока по данным цейтраферной регистрации чипа.
|
1 |
2 |
3 |
|
4 |
5 |
6 |
|
7 |
8 |
9 |
|
10 |
11 |
12 |
Рассмотрим расположенную под некоторым небольшим углом к поверхности ткань в условиях лаборатории на чипе. Вследствие углового расположения, благоприятствующего стеканию по поверхности, формируется градиент, стягивающий книзу и в центр счетной камеры потоки межклеточного вещества, содержащие в себе клетки ткани, принимаемые, аналогично принципам гемодинамики, за частицы. Тогда, в конечном результате, должны образоваться оптические градиенты, соответствующие морфологическим искривлениям и концентрационным градиентам, возникающим вследствие описанного процесса[6]. Пример протекания подобного процесса, зарегистрированного с помощью лазерной визуализации, приведен в таблице 1.
В таблице приведена последовательность состояний поверхности лаборатории на чипе с самоорганизующейся на ней складкой на границе монослоя (за счет реакционно-диффузионных процессов и соответствующего концентрационного градиента), корректно детектируемых при спекл-проецировании на ПЗС структуры, локализованной на чипе. С позиций эмбриологии, на данном цейтрафере, по-видимому, наблюдается формирование, своего рода, аналога деформации эктодермального зародышевого листка. Так как данная статья носит чисто технический характер, авторы не останавливаются на биологических вопросах достаточно подробно, однако очевидно, что возможность получения с помощью лабораторий на чипе информации о протекании гистогенеза культур тканей и клеток при их культивации в динамике и использование формы видеосигнала лаборатории на чипе в качестве идентификационного признака для данного функционального типа клеточных и более высокоорганизованных систем является в совокупности новым методом таксономии и сравнительной гистологии.
Программное обеспечение
Для автоматизированной морфометрии и классификации клеток одним из авторов (А.В. Нотченко) была создана обучающаяся программа, работа которой апробировалась на окрашенных срезах нервной ткани. Задавая весовые коэффициенты спектрозональных каналов (R, G, B), можно классифицировать окрашенные или нативно пигментированные клетки не только морфометрически, но и фотоколориметрически - то есть, осуществлять с её помощью стандартные операции визуальной гистохимии. С её помощью эффективно распознаются препараты, окрашенные по: Ван-Гизону (соединительная ткань), Леффлеру и Цилю - Нельсону (грибы), Гольджи и Нисслю (нейроны / глия), Гинсу - Бурри (капсулы микроорганизмов), Марцелли (эндоспоры), Гомори (мышцы), Гименез (бактерии), Грамму (бактериальная клеточная стенка), трихроматическим методам Лилли и Мэссона, Моват (сердечно-сосудистая система), Grocott (зеленое окрашивание биопсии на гистоплазму), Шефферу - Фултону (бактериальные эндоспоры), GFP (зеленый флуоресцентный белок), Фельгену и Браше (ДНК, РНК). Возможность управления весовыми коэффициентами в программе можно расценивать как альтернативу калибровке спектрозональных каналов до начала мониторинга. Вследствие явлений цветовой метамерии человеческого восприятия данный метод значительно корректнее визуальной или же аддитивной фотометрической оценки окраски и подсчета окрашенных элементов в кадре. Возможность работы с кадром в preview-режиме, то есть до его регистрации, позволяет "обучать" программу, запоминая эталонные форменные элементы или типы клеток в базе в режиме реального времени, но эта функция может быть также использована и при обучении программы по уже готовым цифровым микрофотографиям.
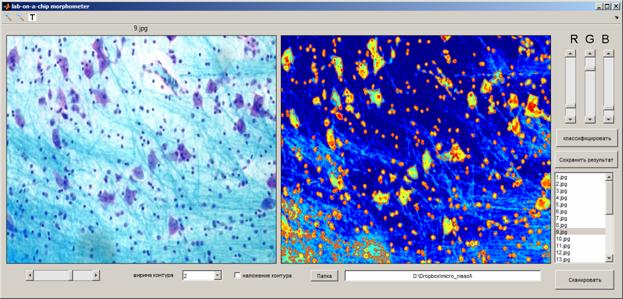
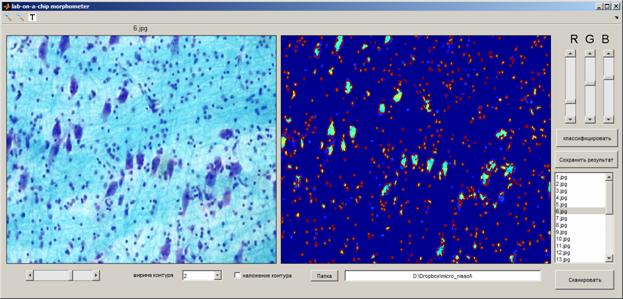
Интерфейс, скриншоты которого приведены на Рис. 8, состоит из визуализационных дисплеев для отображения исходного изображения и карты градиента с морфометрией и классификацией результатов контурного анализа микрообъектов, кнопок классификации и сохранения результатов анализа в файл автоматического отчета, окна скроллинга файлов, кнопки запуска сканирования, задатчика ширины контура и выбора папки локализации исходного изображения (в случае, если он берётся из заданной папки; на Рис. 8 приведен пример захвата файла изображения из портфеля облачного хранилища данных в системе Dropbox).
а
б
Рис. 8. Графический интерфейс пользователя программы "lab-on-a-chip morphometer" в процессе распознавания клеточных элементов на серии срезов, окрашенных по Нисслю.
Таким образом, будучи приспособленной для работы с лабораториями на чипе, описанными в настоящей статье, и нося наименование "lab-on-a-chip morphometer", данная программа, тем не менее, может быть использована для обработки сторонних фотофайлов - в том числе, находящихся в удаленном доступе и доступных через облачные ресурсы. С позиций удаленного пользователя лабораторий на чипе, это даёт возможность достаточно эффективной работы программы в качестве средства телемедицины при обработке данных клинических гистохимических и специфических (или патогномоничных) индикаторов. В связи с простотой обучения программы, в рамках приведенного графического интерфейса пользователя матричной лаборатории (GUI), ограничивающейся нажатием для сохранения соответствующей клавиши, находящейся в левой части окна, использование программы возможно и без участия специалистов в области обработки цифровых изображений.
Особенности применения FITS-формата
Общеизвестно, что формат FITS, оптимальный для профессиональных матриц при научных применениях, включает в себя метаданные фотометрической калибровки. Это дает неоспоримые удобства при его использовании в регистрации данных с лабораторий на чипе по причинам, указанным выше. Вместе с тем, так как связывание блоков данных в FITS позволяет представлять данные файлы как полнофункциональные реляционные базы данных, возникают дополнительные удобства при обращении к ним при облачной форме хранения данных и при использовании удаленных баз. Одновременно в файл пользователь может занести любую пояснительную координацию, что избавляет от необходимости в специализированных каталогах с сопроводительной информацией. Это особенно удобно в случае поточных или скрининговых исследований. Нами были апробированы конвертеры FITS и утилиты, сохраняющие 2D-данные в формате FITS, для достижения этих целей. В листингах 1, 2 приведены примеры выдачи данных лабораторией на чипе в FITS-формате. Можно видеть повышенную информативность формата относительно стандартных форм n-разрядного представления графических данных. Так как, благодаря тому, что в формате FITS могут быть изменены параметры форматов двоичных таблиц и ASCII - символики, а каждый столбец может иметь формат отличный от другого, возможно произвести мэпинг (картирование) любого параметра, связанного с оптическими характеристиками, данными в анализируемом изображении. Удобные возможности для этого содержатся также в парах ключ-значение, в которые лаборант может внести данные о гистохимической процедуре и методах цифровой обработки (мэпинга), примененных при работе с оконечным файлом.
Листинг 1. Выдача FITS-данных лабораторией на чипе.

Листинг 2: FITS - конверсия в NC-формат.

Использование в качестве аналога RFID
В соответствии с ISO - стандартами RFID для биологической идентификации[7], и ISO - стандартами управления переносимыми объектами и товарами[8], существуют диапазоны частот, оптимальные для RFID-идентификации на определённых расстояниях. Частично эти диапазоны перекрываются с частотами приемопередачи радиочастотных лабораторий на чипе. Так, например, как указывалось выше, ресиверы ENC и P-817GA или ZT-901GA, используемые при работе с лабораториями на чипе, детектируют частоты 1.2 / 2.4 ГГц и 2.42 / 2.483 ГГц, в то время как RFID - ридер типа 217001 работает в диапазоне частот 2.4 - 2.5 ГГц, а радиочастотный усилитель для RFID - идентификации UPC2792TB-E3 имеет полосу, включающую частоту 1.2 ГГц. Поэтому, при весьма незначительных доработках, системы RFID - детектирования и трансляции видеосигнала лаборатории на чипе могут быть сопряжены. Таким образом, может быть преодолена "искусственность" RFID - метки по отношению к помечаемому ей объекту - лаборатории на чипе.
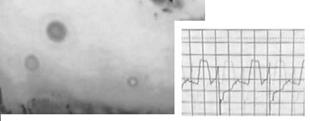
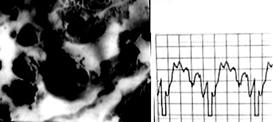
Действительно, логично производить идентификацию не по "абстрактному" сигналу метки RFID, а путём фингерпринтинга сигнала, напрямую коррелирующего с состоянием содержимого лаборатории на чипе. В частности, целесообразно характеризовать спектры, фотоколориметрические показатели, периодограммы, динамические характеристики. Обо всем этом будет рассказано в следующих статьях. О том, насколько патогномоничной и специфической эвристической ценностью может обладать видеосигнал лаборатории на чипе, можно судить по сравнению сигналов двух желатин-содержащих сред с различными микоструктурами, образовавшимися при различных температурах и влажностях. Пример подобного эксперимента с осциллографией низкочастотной компоненты сигнала приведен на Рис.9. Спектр красного сигнала соответствует 1.6 - 1.8 МГц, а зеленого - примерно 6 МГц, поэтому с помощью анализатора спектра можно определить наличие микрофлоры - фотосинтезирующих структур с максимумом в зеленой области - или красной плесени - с максимумом в области, соответствующей красному каналу. Таким образом, частотная или спектральная идентификация может быть средством мониторинга состояния культур на чипах и элементом процедуры выбраковки некондиционных носителей из культивации[9].
а б
Рис. 9. Осциллография видеосигнала двух Gel-содержащих носителей: а - культура с малой оптической плотностью и удельной концентрацией клеточных элементов; б - с высокой оптической плотностью и повышенной концентрацией клеточных элементов.
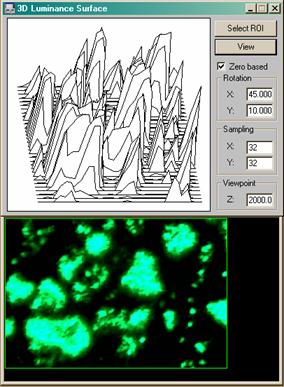
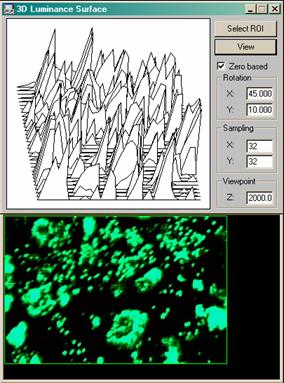
Рис. 10. Построение трёхмерных профилей люминанса (светимости) в ПО "Optimas".
Особенности коротковолновой регистрации
При использовании декамикронных или полуторадекамикронных матриц с обратной засветкой, обеспечивающих высокую эффективность фотоэффекта в коротковолновой и, в чсастности, в ультрафиолетовой области спектра, возможно спектрохимически расширить возможности описанной системы, допустив ультрафиолетовое облучение бактерицидного действия в качестве детектируемого фактора стерильности культуральных сред и чашек, а также в качестве источника возбуждения люминесценции флуорохромов, используемых при окрашивании гистохимических препаратов или же в качестве витальных красителей. В таком случае передаваться и обрабатываться на ЭВМ будет и сигнал люминесценции с получением профилей люминанса, и профиль УФ-пучка, визуализируемый изофотами или картой градиента в псевдоцвете. Повышение разрешающей способности с использованием субпиксельно смещенных линеек, целесообразное при использовании коротковолнового излучения, для конструкций лабораторий на чипе не является достижимым вследствие контактного типа регистрации, поэтому исходно имеет смысл сопоставить необходимость в том или ином методе флуоресцентного детектирования с разрешающей способностью матрицы (без учета интерполяции). Использование многослойных матриц типа Foveon X3, несмотря на высокое физическое разрешение, возможность считывания спектрозональной информации по трем каналам с одного пикселя (у обычной матрицы с фильтрами Байера это невозможно) и возможность относительно корректного синтеза мультиспектральных данных при использовании многослойных фильтров, при работе с ультрафиолентовыми излучателями нежелательно, так как в силу высокой оптической плотности фильтров и их колориметрических характеристик, пропускание в УФ - диапазоне чрезвычайно мало, что очевидно препятствует корректному сопоставлению 3D-профилей люминанса с профилем возбуждающего люминесценцию пучка (пример профилирования люминанса приведен на Рис. 10).
Заключение
Таким образом, конструктивно элементарная система, базирующаяся на простейших свойствах приборов с зарядовой связью и способная быть реализованной неспециалистом, выполняет функцию лаборатории на чипе и гемоцитометра / гематиметра. Мы выражаем благодарность сотрудникам НЦН РАМН Панову В.В. и Иванову М.В. за тестирование программного обеспечения, описанного в работе.
Литература
1. Ghallab Y.H., Badawy W. Lab-on-a-chip: Techniques, Circuits, and Biomedical Applications. Artech House, 220 p., 2010.
2. Barbulovic-Nad I., Au S.H., Wheeler A.R. A microfluidic platform for complete mammalian cell culture, Lab. Chip., Vol. 10, pp. 1536-1542 (2010).
3. Hufnagel H., Huebner A., Gülch C., Güse K., Abell C., Hollfelder F. An integrated cell culture lab on a chip: modular microdevices for cultivation of mammalian cells and delivery into microfluidic microdroplets. Lab. Chip., Vol. 9, pp. 1576-1582 (2009).
4. Walker G.M., Zeringue H., Beebe D.J. Microenvironment design considerations for cellular scale studies, Lab. Chip., Vol. 4, pp. 91-97 (2004).
5. Paguirigan A, and D. J. Beebe, Microfluidics, meet cell biology: bridging the gap by validation and application of microscale techniques for cell biological assays, Bioessays, Vol. 30, pp. 811-821 (2008).
6. Domenech M., Yu H., Warrick J., Badders N.M., Meyvantsson I., Alexander C.M., Beebe D.J. Cellular observations enabled by microculture: paracrine signaling and population demographics, Integrative Biology, Vol. 1, pp. 267 – 274 (2009).
7. Satoh W., Takahashi S., Sassa F., Fukuda J., Suzuki H. On-chip culturing of hepatocytes and monitoring their ammoniametabolism, Lab. Chip., Vol. 9, pp. 35-37 (2009).
8. Jebrail M.J., Wheeler A.R. Let's get digital: digitizing chemical biology with microfluidics, Current Opinion in Chemical Biology, Vol. 14, Issue 5, pp. 574-581 (2010)
9. Wheeler B.C., Brewer G.J. Designing Neural Networks in Culture, Proceedings of the IEEE, Vol. 98, Issue 3, pp. 398-406 (2010).
10. Hardelauf H., Sisnaiske J., Taghipour-Anvari A.A., Jacob P., Drabiniok E., Marggraf U., Frimat J.-P., Hengstler J.-G., Neyer A., van Thriel C., West J. High fidelity neuronal networks formed by plasma masking with a bilayer membrane: analysis of neurodegenerative and neuroprotective processes. Lab. Chip., Vol. 11, pp. 2763-2771 (2011).
11. Vishwanathan A., Bi G.-Q., Zeringue H.C. Ring-shaped neuronal networks: a platform to study persistent activity. Lab. Chip., Vol. 11, pp. 1081-1088 (2011).
12. Pedersen S., Kutchinsky J., Friis S., Krzywkowski K., Tracy C.L., Vestergaard R., Sorensen C.B., Vennerberg H., Taboryski R. An electrophysiological lab on a chip. TRANSDUCERS, Solid-State Sensors, Actuators and Microsystems, 12th Int. Conf. (2003), Vol. 2, pp. 1059-1062.
13. Ionescu-Zanetti C., Shaw R.M., Seo J., Jan Y.-J., Jan L.Y. Lee L.P. Mammalian electrophysiology on a microfluidic platform, PNAS, Vol. 102, No. 26, pp. 9112-9117 (2005).
14. Mohammed J.S., Caicedo H.H., Fall C.P., Eddington D.T. Microfluidic add-on for standard electrophysiology chambers. Lab Chip, Vol. 8, pp. 1048-1055 (2008).
15. Ulhaque A., Rokkam M., De Carlo A.R., Wereley S.T., Roux S.J., Irazooqi P.P., Porterfield D.M. A MEMS fabricated cell electrophysiology biochip for in silico calcium measurements, Sensors and actuators. B, Chemical, Vol. 123, No 1, pp. 391-399 (2007).
16. Wang C.J., Li X., Lin B., Shim S., Ming G., Levchenko A. A microfluidics-based turning assay reveals complex growth cone responses to integrated gradients of substrate-bound ECM molecules and diffusible guidance cues Lab Chip, 2008, 8, pp. 227-237 (2008).
17. Liu Y., Smela E., Nelson N.M., Abshire P. Cell-lab on a chip: a CMOS-based microsystem for culturing and monitoring cells. IEEE Eng. Med. Biol. Soc., No. 4, pp.2534-2537 (2004).
18. Eltoukhy H., Salama K., Gamal A.E. A 0.18-μm CMOS bioluminescence detection lab-on-chip, Solid-State Circuits IEEE, Vol. 41, Issue 3, pp.651-662 (2006).
19. Lee H., Liu Y., Ham D., Westervelt R.M. Integrated cell manipulation system-CMOS/microfluidic hybrid. Lab Chip, Vol. 7, pp. 331-337 (2007).
20. Ghafar-Zadeh E., Sawan M., Therriault D. A 0.18-μm CMOS capacitive sensor Lab-on-Chip, Sensors and Actuators A: Physical, Vol. 141, Issue 2, pp. 454-462 (2008).
21. Ozawa T., Kinoshita K., Kadowaki S., Tajiri K., Kondo S., Honda R., Ikemoto M., Piao L., Morisato A., Fukurotani K., Kishi H., Muraguchi A. MAC-CCD system: a novel lymphocyte microwell-array chip system equipped with CCD scanner to generate human monoclonal antibodies against influenza virus. Lab Chip, Vol. 9, pp. 158-163 (2009).
22. Balsam J., Ossandon M., Kostov Y., Bruck H.A., Rasooly A. Lensless CCD-based fluorometer using a micromachined optical Söller collimator. Lab Chip, Vol. 11, pp. 941-949 (2011).
23. Muhlberger H., Hwang W., Guber A., Saile V., Hoffmann W. Polymer Lab-on-a-Chip System With Electrical Detection. IEEE Sensors Journal, Vol 8, pp. 572-579 (2008).
24. Васин Б.Л., Малькова С.В., Осипов М.В., Пузырёв В.Н., Саакян А.Т., Стародуб А.Н., Федотов С.И., Фроня А.А. Методика измерения спектральной чувствительности ПЗС-матрицы. Препринт ФИАН, № 18 - 2007, 20 стр.
25. Злобин В.К., Еремеев В.В. Обработка аэрокосмических изображений. М., Физматлит, 2006, 304 с.
[1] В таком случае следует рассмотреть возможность охлаждения чипа ПЗС элементом Пельтье до оптимума температур, не искажающего сигнал с одной стороны, и нативное состояние биоструктур, с другой стороны.
[2] Ничто не мешает использованию сеток Тюрка, Предтеченского, Горяева и др., отличающихся от указанных количественно, но не качественно. От этого будет зависеть только микрометрическая юстировка по ним.
[3] За идеал был принят ПЗС Prinston Instruments LN/CCD-1100-PB/UVAR/1, охлаждаемый жидким азотом. В случае КМОП охлаждаемого эквивалента не требовалось и юстировка велась в цифровом режиме.
[4] Примером эквивалентной "ручной" процедуры может служить веб-сервис с усреднением вводимых в виртуальный сортирующий счетчик клеток (http://www.currentprotocols.com/tools/hemacytometer-calculation-tool) значений количества микрообъектов, подсчитываемых на площади ячеек (в условиях неавтоматической классификации их по группам).
[5] Используя эти понятия, авторы не вносят в них нефизического содержания, понимая, аналогично генетику Н.К,Кольцову, что в процессе морфогенеза изменяется распределение структурных компонент ткани, при котором "потенциалы в полюсах силового поля могут быть электрические, гравитационные, механические, капиллярно-активные, химические" (Кольцов Н.К. Организация клетки, М.-Л., Биомедгиз, 1936, стр. 564).
[6] Если же использовать саму оптическую считывающую систему для управления градиентами и, как следствие, процессом морфогенеза, то процесс диагностирования и прогнозирования его состояния будет рационализирован для применения в лаборатории на чипе без отдельной системы регулирующих обратных связей.
[7] ISO 11784, ISO 11785, ISO 14223
[8] DIN/ISO 69873, ISO/IEC, VDI 4470, ISO 15961, ISO 15962, ISO 18000, ISO 18001
[9] В связи с этим возникает возможность использовать её также в полевых условиях в случае возможности дистанционного мониторинга состояния закладываемых культивационных чипов. Это описывается в одной из наших следующих работ.











